
Autor dr n. med. Magdalena Jodkiewicz | 28.09.2022 | Nowotwory
Czynniki ryzyka zachorowania na raka piersi
Zgodnie z ostatnim raportem World Cancer Research Fund/American Institute for Cancer Research istnieją niekwestionowane dowody wskazujące na zwiększone ryzyko występowania raka piersi po menopauzie u kobiet z nadwagą i otyłością w okresie dorosłości (po 30. roku życia). Rośnie ono wraz ze wzrostem masy ciała w wieku dorosłym.
Na zwiększone prawdopodobieństwo zachorowania w tej grupie kobiet mają również wpływ: wysoki wzrost, niska aktywność fizyczna oraz spożywanie alkoholu.
Ryzyko zachorowania na raka piersi jest mniejsze u kobiet, które karmiły piersią. Istnieją też ograniczone dowody dotyczące zmniejszonego ryzyka zachorowania na raka piersi u kobiet, które spożywają warzywa nieskrobiowe, produkty zawierające karotenoidy oraz bogate w wapń.
Istnieje jeszcze wiele innych czynników ryzyka zachorowania na raka piersi takich jak: płeć, starszy wiek, rodzinne występowanie raka piersi, nosicielstwo mutacji genów (BRCA1 i BRCA2), wczesne wystąpienie pierwszej miesiączki, menopauza w późnym wieku, pierwsza donoszona ciąża w późnym wieku, brak ciąż, radioterapia w obszarze klatki piersiowej przed 30. rokiem życia i niektóre choroby rozrostowe piersi, a także palenie papierosów.
Tabela 1. Żywieniowe czynniki zwiększające i zmniejszające ryzyko rozwoju nowotworu piersi
| Zwiększające ryzyko |
Zmniejszające ryzyko |
| Nadwaga i otyłość po menopauzie |
Warzywa i owoce |
| Dieta wysokoenergetyczna, wysokotłuszczowa |
Wielonienasycone kwasy tłuszczowe omega-3 |
| Izomery trans kwasów tłuszczowych |
Fitoestrogeny |
| Wielonienasycone kwasy tłuszczowe omega-6 |
Zielona herbata |
| Mięso czerwone i jego przetwory |
|
| Węglowodany proste |
|
| Alkohol |
|
Rak piersi – profilaktyka
Profilaktyka pierwotna raka piersi jest ograniczona. Do czynników modyfikowalnych należą czynniki żywieniowe takie jak: zapobieganie nadwadze i otyłości poprzez unikanie zachodniego modelu żywienia, ograniczenie spożywania alkoholu oraz eliminacja czynnego i biernego palenia tytoniu, a także wzmożona aktywność fizyczna. W przypadku grupy bardzo wysokiego ryzyka dodatkowo stosuje się profilaktyczne zabiegi operacyjne w postaci amputacji piersi lub/i usunięcia jajników z jajowodami.
W celu wczesnego wykrywania raka piersi jedyną skuteczną metodą są przesiewowe badania mammograficzne. W przypadku braku objawów i dodatkowych czynników ryzyka wykonuje się je po 50. roku życia co 24 miesiące. W każdym wieku zaleca się badanie palpacyjne w ramach rutynowych badań lekarskich co 6-12 miesięcy oraz samobadanie piersi raz w miesiącu. Pierwsze USG piersi warto wykonać już w wieku 20 lat i powtarzać je co 2 lata, a po ukończeniu 30. roku życia nawet częściej. Prawidłowo zaplanowany i prowadzony program przesiewowych badań mammograficznych zmniejsza umieralność na raka piersi.
Otyłość a rak piersi
Mechanizm wpływu otyłości na ryzyko rozwoju raka piersi dotyczy przede wszystkim nadmiernej ilości tkanki tłuszczowej i związanymi z tym zaburzeniami metabolizmu.
Analiza wielu badań klinicznych wskazuje na związek między otyłością, a zwiększonym ryzykiem wystąpienia raka piersi zarówno u kobiet przed, jak i po menopauzie. Liczne badania potwierdziły, że kobiety z otyłością II i III stopnia miały większe ryzyko zachorowania na raka piersi niż kobiety o prawidłowej masie ciała. Dodatkowo większe ryzyko zachorowania zaobserwowano u otyłych kobiet po menopauzie.
Według AICR (ang. American Institute of Cancer Research) nadmierna masa ciała odpowiada za aż 30-40% przypadków nowotworów złośliwych, do których należą:
- gruczołowy rak przełyku,
- estrogenozależny rak piersi po menopauzie,
- rak prostaty,
- rak jelita grubego,
- rak trzonu macicy,
- rak jajnika,
- rak pęcherzyka żółciowego,
- rak nerkowokomórkowy,
- rak wątrobowokomórkowy
- niektóre typy raka żołądka i nowotwory narządów głowy i szyi.
Otyłość jest niezależnym czynnikiem prognostycznym i koreluje z gorszą odpowiedzią na leczenie onkologiczne. Otyłość wiąże się też z krótszym przeżyciem całkowitym i krótszym czasem do nawrotu choroby.
Odżywianie w chorobie nowotworowej piersi – zalecenia dietetyczne
Poradnictwo dietetyczne u chorych na raka piersi odbiega od terapii innych nowotworów, ponieważ nowotwór ten nie dotyczy przewodu pokarmowego i zazwyczaj pacjenci nie mają dolegliwości ze strony przewodu pokarmowego. Wyjątkiem jest czas leczenia – chemioterapia. Dieta przy nowotworze piersi powinna być ustalana indywidualnie, w zależności od dolegliwości ze strony przewodu pokarmowego i chorób współistniejących. W czasie chemioterapii najczęściej pojawią się: jadłowstręt, nudności i wymioty oraz rzadziej biegunki i zaparcia.
W przypadku braku problemów trawiennych szczególny nacisk należy położyć na utrzymanie prawidłowej masy ciała lub przy nadwadze i otyłości jej redukcję.
Redukcja masy ciała u chorych na nowotwory nie powinna zacząć się w trakcie agresywnej terapii onkologicznej, jaką jest np. chemioterapia, radioterapia czy okres okołooperacyjny. Wyjątkiem są sytuacje przed operacją, kiedy lekarz zaleca otyłym chorym redukcję masy ciała w celu zmniejszenia ryzyka operacyjnego oraz poprawy gojenia się ran. Bezpiecznym momentem na rozpoczęcie redukcji masy ciała jest hormonoterapia lub zakończenie terapii onkologicznej.
Dieta dla chorych na raka piersi, tak jak dla zdrowych osób obejmuje redukcję nadmiernej masy ciała poprzez zdrowe zasady żywienia z elementami profilaktyki przeciwnowotworowej.
- Niestosowanie diet restrykcyjnych i niekonwencjonalnych
- Redukcja masy ciała jako trwała zmiana sposobu żywienia, a nie wyłącznie kilkutygodniowa dieta
- Regularność posiłków (bez podjadania między posiłkami)
- Kompletność diety (posiłki powinny zawierać białko, tłuszcze i węglowodany, a także wszystkie mikroskładniki oraz produkty bogate w błonnik)
- Wyliczenie indywidualnego zapotrzebowania energetycznego – zazwyczaj wynosi
ono od 25 do 35 kcal/kg należnej mc./dzień. Maksymalny deficyt kaloryczny powinien wynosić 300-500 kcal w stosunku do całkowitego zapotrzebowania
- Nieprzekraczanie zalecanej utraty masy ciała (2-4 kg w miesiącu)
- Indywidualne dostosowanie udziału poszczególnych makroskładników w diecie – zazwyczaj proponowany to: białko 10-20%, węglowodany 45-65%, tłuszcz 20-35%
- Ograniczenie węglowodanów łatwo przyswajalnych.
- Ograniczenie nasyconych kwasów tłuszczowych i wielonienasyconych kwasów tłuszczowych omega-6
- Zwiększenie ilości błonnika (min. 25g/dzień)
- Zapewnienie odpowiedniego nawodnienia organizmu (2 litry wody w ciągu dnia)
Aktywność fizyczna
Aktywność fizyczna chorobie nowotworowej piersi, tak jak żywienie, jest niezbędnym elementem pierwotnej i wtórnej profilaktyki nowotworów, a także redukcji masy ciała. Leczenie onkologiczne nie jest przeciwwskazaniem do utrzymania aktywności fizycznej, natomiast powinna być ona dostosowana do możliwości pacjenta i wcześniej skonsultowana z lekarzem.
Aktywność fizyczna zmniejsza ryzyko zachorowania na nowotwory piersi (po- i przedmenopauzalne), jelita grubego, endometrium oraz prostaty, a także zmniejsza ryzyko zgonu u osób, które zwiększyły aktywność fizyczną po rozpoznaniu choroby.
Czy warto stosować suplementację?
Nie istnieją wytyczne dotyczące zalecanych ilości witamin i składników mineralnych dla pacjentów onkologicznych. Dlatego powinny one być zalecane w ilościach pokrywających zapotrzebowanie dobowe takie samo jak dla zdrowego człowieka (na poziomie dziennego zalecanego spożycia).
W przypadku raka piersi prowadzone są liczne badania na temat zastosowania witaminy D w profilaktyce oraz leczeniu. Wyniki tych badań zarówno w kontekście wpływu witaminy D na nowotworzenie, jak i leczenie są kontrowersyjne i niejednoznaczne.
Piśmiennictwo
- Didkowska J., Wojciechowska U., Czaderny K., Olasek P., Ciuba A.: Nowotwory złośliwe w Polsce w 2019 roku. Narodowy Instytut Onkologii – Państwowy Instytut Badawczy im. Marii Skłodowskiej- Curie w Warszawie, Warszawa 2021.
- Jassem J., Krzakowski M., Bobek-Billewicz B. i wsp.: Breast cancer. Oncol. Clin. Pract. 2018: 14(4): 171-215. doi: 10.5603/OCP.2018.0027. Jassem J., Krzakowski M. i wsp.: Rak piersi – wytyczne postępowania diagnostyczno-terapeutycznego. Onkol. Prakt. Klin. Edu. 2018; 4(4): 209-256.
- Kłęk S., Jankowski M., Kruszewski W. J., Fijuth J., Kapała A., Kabata P., Wysocki P., Krzakowski M., Rutkowski P.: Clinical Nutrition in Oncology: Polish Recommendations. Oncol. Clin. Pract. 2015; 11(4): 172–188.
- Brzegowy M., Maciejewska-Cebulak M., Turek K.: Nie daj się rakowi! Wsparcie żywieniowe w chorobie nowotworowej. Wydawnictwo M., Kraków, 2018.
- World Cancer Research Found International & American Institute of Cancer Research Continous Update Project: World Cancer Research Found International. Continous Update Project, Analysing research on cancer prevention and survival: Diet, nutrition, physical activity and breast cancer. Revised 2018 [online][dostęp: 28.09.2022]. Dostępny w: https://www.wcrf.org/wp-content/uploads/2021/02/Breast-cancer-report.pdf
- Neuhouser M.L., Aragaki A.K., Prentice R.L. et al.: Overweight, obesity and postmenopausal invasive breast cancer risk: A secondary analysis of the Women’s Health Initiative randomized clinical trials. JAMA Oncol. 2015; 1(5): 611-621. doi: 10.1001/jamaoncol.2015.1546.
- Chan D.S., Vieira A.R., Aune D. et al: Body mass index and survival in women with breast cancer – systematic literature review and meta-analysis of 82 follow-up studies. Ann. Oncol. 2014;25(10): 1901−1914. doi: 1093/annonc/mdu042.
- https://www.aicr.org/resources/media-library/what-you-need-to-know-about-obesity-and-cancer/ [dostęp: 18.08.2022]
- Estébanez N., Gómez-Acebo I., Palazuelos C., Llorca J., Dierssen-Sotos T.: Vitamin D exposure and Risk of Breast Cancer: a meta-analysis. Sci. Rep. 2018; 8(1): 9039. doi: 1038/s41598-018-27297-1.
- Mutlu H., Colak T. et al.: The effect of seasonal differences on prognostic factors in Turkish patients with breast cancer. Eur. J. Cancer Prev. 2011; 20(6): 475-477. doi: 10.1097/CEJ.0b013e3283476175.
- Manson J.E., Cook N.R., Lee I.M. et al.: Vitamin D Supplements and Prevention of Cancer and Cardiovascular Disease. VITAL Research Group. N. Engl. J. Med. 2019; 380(1): 33-44. doi: 10.1056/NEJMoa1809944.
- Crew K.D., Anderson G.L., Hershman D.L. et al.: Randomized Double-Blind Placebo-Controlled Biomarker Modulation Study of Vitamin D Supplementation in Premenopausal Women at High Risk for Breast Cancer (SWOG S0812). Randomized Controlled Trial. Cancer Prev. Res. (Phila) 2019; 12(7): 481-490. doi: 10.1158/1940-6207.CAPR-18-0444.
- Ebeling P.R.: Does vitamin D supplementation reduce cardiovascular events and cancer? Am. J. Clin. Nutr. 2022; 115(5):1255–1256. doi: 10.1093/ajcn/nqac050.

Autor dr n. med. Magdalena Jodkiewicz | 23.08.2022 | Nowotwory
Ten sposób leczenia oddziałuje na cały organizm, dlatego towarzyszy mu szereg skutków ubocznych takich jak zaburzenia produkcji elementów morfotycznych i wzrost stężenia enzymów wątrobowych. Także dolegliwości trawienne, często wynikające z uszkodzenia błony śluzowej przewodu pokarmowego, mogą wpływać na utratę masy ciała i w konsekwencji niedożywienie.
Skutkiem ubocznym chemioterapii jest też wypadanie włosów i łamliwość paznokci, którym nie da się zapobiec żywieniem i nie wynika to z nieprawidłowego sposobu żywienia.
Żywienie w trakcie chemioterapii
Zastanawiasz się, co jeść przy chemioterapii? Sposób żywienia w trakcie chemioterapii powinien być dostosowany indywidualnie, uwzględniając stan odżywienia pacjenta, lokalizację i stopień zaawansowania nowotworu oraz dolegliwości ze strony przewodu pokarmowego. Nie ma jednej uniwersalnej diety dla wszystkich chorych leczonych chemioterapią. Dopóki pacjent nie ma dolegliwości ze strony przewodu pokarmowego, dieta podczas chemioterapii powinna opierać się na prawidłowo zbilansowanych posiłkach, co ma na celu zapobieganie niedożywieniu.
W przypadku pojawienia się problemów trawiennych zadaniem diety jest zminimalizowanie odczuwania skutków ubocznych chemioterapii. W takiej sytuacji często zaleca się stosowanie łatwostrawnych posiłków. Lekkostrawna dieta w czasie chemioterapii odciąży przewód pokarmowy oraz ułatwi trawienie i wchłanianie składników odżywczych.
Do głównych zasad tej diety należy eliminacja potraw smażonych, surowych warzyw i owoców, pełnoziarnistych produktów zbożowych oraz produktów tłustych i wzdymających.
Produkty przeciwwskazane w trakcie chemioterapii
Jedyna bezwzględna zasada żywienia w trakcie chemioterapii dotyczy eliminacji grejpfruta i jego przetworów.
Powodem są zawarte w tym owocu flawonoidy (furanokumaryny i seskwiterpeny), które hamują aktywność enzymów odpowiedzialnych za biotransformację leku, co w konsekwencji może zmieniać metabolizm leków i nasilić toksyczność chemioterapii. O podobne działanie podejrzewa się także owoc granatu, jednak dane literaturowe na ten temat są niespójne.
Czy w trakcie chemioterapii trzeba stosować dietę bezmleczną/bezlaktozową?
Żywienie w czasie chemioterapii nie wyklucza spożywania produktów mlecznych. Nie ma wskazań do rutynowego stosowania diety bezlaktozowej, jednak nietolerancja laktozy może być konsekwencją leczenia cytostatykami.
Przyczyną tego może być uszkodzenie funkcji nabłonka jelitowego i w konsekwencji niewystarczająca synteza laktazy, czyli enzymu, który ją rozkłada. W takiej sytuacji często wystarczająca jest zamiana nabiału na produkty bezlaktozowe, a nie całkowita eliminacja produktów mlecznych z diety.
Zgodnie ze Standardami Żywienia w Onkologii wskazaniem do zastosowania diety bezlaktozowej jest chemioterapia oparta na lekach, takich jak: lapatynib, kapecytabina, 5-fluorouracyl, irynotekan, topotekan czy inhibitory kinaz. Rzadziej eliminacji laktozy mogą wymagać chorzy na nowotwory krwi i układu chłonnego leczeni chemioterapią wysokodawkową.
Przykładowe skutki uboczne chemioterapii – nudności i wymioty
Do częstych powikłań chemioterapii należą nudności i wymioty. Utrudniają one żywienie podczas chemioterapii, co może przyczyniać się do niedoborów pokarmowych i w konsekwencji pogorszenia stanu odżywienia organizmu. Mogą również znacząco wpływać na osłabienie i brak energii, które i tak już towarzyszą pacjentom onkologicznym. Niekiedy są one też powodem przerwania leczenia. Nudności i wymioty pod względem klinicznym można podzielić na kilka grup:
- wczesne – pojawiają się w pierwszej dobie po chemioterapii,
- późne – pojawiają się od drugiej doby po podaniu cytostatyków,
- poprzedzające – mają podłoże psychogenne i występują już przed podaniem chemioterapii,
- oporne na leczenie – utrzymują się pomimo podawania leków przeciwwymiotnych.
Ryzyko i stopień nasilenia występowania nudności i wymiotów są indywidualne i mogą zależeć od rodzaju i zaawansowania choroby, rodzaju zastosowanego leczenia i dawki cytostatyków, a także długości wlewu oraz ilości cykli.
Zalecenia dietetyczne – nudności i wymioty
Jaka powinna być dieta przy chemioterapii gdy występują niepożądane objawy? To pytanie często zadają pacjenci na wizytach. Pomimo postępu w terapii farmakologicznej nudności i wymiotów oraz stosowania środków przeciwwymiotnych warto równolegle wprowadzić właściwe postępowanie dietetyczne. Posiłki łatwostrawne powinny być podstawą podczas chemioterapii, które nie będzie długo zalegać w przewodzie pokarmowym. Czasami zalecana jest też modyfikacja konsystencji diety do papkowatej lub płynnej. Pokarmy rozdrobnione, które są gotowe do przełknięcia, bez konieczności gryzienia są często dużym ułatwieniem w przyjmowaniu posiłków u takich chorych. Przykładem są wszelkiego rodzaju puree warzywne lub ziemniaczane, musy i koktajle lub posiłki zmiksowane, np. zupy krem. W trakcie nudności i wymiotów należy unikać produktów spożywczych, które mogą je nasilać. Należą do nich przede wszystkim: produkty bogate w błonnik, ciężkostrawne, wzdymające warzywa, posiłki tłuste i smażone oraz żywność typu fast food.
W celu zmniejszenia nudności i wymiotów pacjentom zaleca się:
- spożywanie posiłków często (co 2-3 godziny) i o małej objętości,
- spożywanie posiłków w wywietrzonych pomieszczeniach lub na świeżym powietrzu,
- spożywanie posiłków o temperaturze pokojowej, o łagodnym zapachu, ponieważ gorące i intensywnie pachnące posiłki stymulują ośrodek węchowy w mózgu i nasilają nudności i wymioty,
- utrzymywanie pozycji pionowej po posiłkach, co zapobiega cofaniu się treści pokarmowej z przewodu pokarmowego.
Nawodnienie
Jednym z ważniejszych aspektów przy nudnościach i wymiotach jest odpowiednie nawodnienie organizmu (podaż płynów ok. 1,5-2 litrów, czyli ok. 6-8 szklanek). Odwodnienie nasila nudności oraz wydłuża czas metabolizowania leków. W czasie tych dolegliwości i wymiotów zaleca się przyjmowanie płynów o działaniu przeciwwymiotnym takich jak: woda mineralna, napój imbirowy, herbata imbirowa, czarna herbata bez dodatków.
Produkty przeciwwskazane – nudności i wymioty
W sytuacji wystąpienia nudności i wymiotów przeciwwskazane jest spożywanie produktów podrażniających błonę śluzową żołądka takich jak mocny napar z kawy. Dodatkowo niepolecane jest spożywanie naparu z mięty, ponieważ wpływa on na rozszerzenie dolnego zwieracza przełyku i może prowokować wymioty.
Produkty o działaniu przeciwwymiotnym
W celu zmniejszenia nudności i wymiotów pacjentom zaleca się spożywanie imbiru w postaci naparów, herbat, a także ssanie cukierków imbirowych lub plastrów świeżego imbiru. Imbir to naturalny produkt spożywczy o działaniu przeciwwymiotnym.
Przykładowe skutki uboczne chemioterapii – zaburzenia odczuwania smaku i brak apetytu
W przypadku osób chorych brak apetytu i niechęć do jedzenia może wynikać ze złego samopoczucia i zmęczenia spowodowanego leczeniem. Może to być też konsekwencja zaburzeń smaku, dolegliwości bólowych lub innych przypadłości ze strony przewodu pokarmowego. Bardzo ważne jest, aby w takiej sytuacji urozmaicać dietę i korzystać z produktów zmniejszających skutki uboczne leczenia.
Zaburzenia w odczuwaniu smaku mogą prowadzić do ograniczenia ilości przyjmowanych pokarmów, a w konsekwencji spowodować utratę masy ciała.
Zalecenia dietetyczne – zaburzenia odczuwania smaku i brak apetytu
Oprócz stosowania leków zwiększających apetyt, chorych należy objąć także opieką dietetyczną. W tym przypadku, podobnie jak przy nudnościach i wymiotach, punktem wyjścia również jest stosowanie diety łatwostrawnej. Dodatkowo chorym zaleca się, aby posiłki były spożywane w spokojnej atmosferze. W trakcie spożywania posiłku nie powinno się korzystać się z tzw. „rozpraszaczy”, czyli oglądania telewizji, czytania gazet, korzystania ze sprzętów elektronicznych, czy też innych form odciągających uwagę od posiłku.
Preferencje chorego powinny głównym czynnikiem, który bierzemy pod uwagę układając dietę podczas chemioterapii. Jadłospis powinien zawierać w większości posiłki łatwostrawne, chociaż zdarzają się sytuacje, gdy produkty niezalecane w diecie łatwostrawnej mogą być dobrze tolerowane przez chorego w trakcie chemioterapii. i trzeba to wziąć pod uwagę. Przykładem takiej sytuacji jest niewykluczanie z diety ostrych przypraw. W diecie łatwostrawnej są one przeciwwskazane, natomiast u niektórych chorych trakcie chemioterapii są dobrze tolerowane, a wręcz poprawiają stopień odczuwania smaku i chęć na spożycie posiłku.
Często zgłaszanym problemem pacjentów w trakcie chemioterapii jest niechęć do mięsa. Przejawia się ona nie tylko w metalicznym posmaku, ale również awersji do jego zapachu. Podobnie jest w przypadku zapachu i smaku ryb, które wzmagają nudności i wymioty. W praktyce bardzo dobrze tolerowanym źródłem białka w trakcie chemioterapii są jajka, szczególnie ugotowane na miękko lub w formie jajecznicy. Gorzej tolerowane są jajka ugotowane na twardo. Innym źródłem białka mogą być fermentowane produkty mleczne. W przypadku nudności i wymiotów zaleca się spożywanie produktów naturalnych. Mleko natomiast jest lepiej tolerowane w takich formach jak np. budyń. Stopień jego gęstości można dostosować do możliwości gryzienia i przełykania oraz preferencji chorego.
W celu zmniejszenia zaburzeń odczuwania smaku i braku apetytu chorym zaleca się:
- spożywanie często małych porcji posiłków – nawet 6-8 razy dziennie,
- podawanie posiłków na dużych talerzach, co optycznie zmniejszy posiłek,
- spożywanie posiłków w wywietrzonych pomieszczeniach lub na świeżym powietrzu,
- przygotowywanie posiłków kolorowych i smacznych,
- doprawianie posiłków zgodnie z preferencją pacjenta, najlepiej używając świeżych ziół, cytryny, limonki, octu balsamicznego,
- przygotowanie posiłków łatwiejszych do spożycia np. częściowo rozdrobnionych takich jak: koktajle, zupy kremy, musy, pasty, galaretki, kisiele, puree z warzyw i owoców, miękkie pulpety w sosie,
- korzystanie ze sztućców innych niż metalowe w przypadku metalicznego posmaku w ustach,
- spożywanie mięsa w lepiej tolerowanej formie np. w marynatach z dodatkiem owoców takich jak mus z jabłek lub sos żurawinowy, a także w marynatach ze śmietany, mleczka kokosowego lub z dodatkiem soku z cytryny,
- włączenie do diety zimnych produktów spożywczych: sorbety owocowe, pokrojone i zamrożone kawałki banana, a także ssanie kostek z zamrożonego ananasa, arbuza lub innych mrożonych owoców (malin, truskawek) w celu stymulacji smaku,
- zwiększenie aktywności fizycznej w postaci lekkiego wysiłku lub spaceru na świeżym powietrzu – aktywność fizyczna musi być dostosowana do możliwości pacjenta.
„Wzmacnianie” diety
Z powodu utraty apetytu i w konsekwencji niezamierzonej redukcji masy ciała należy naturalnie zwiększać wartość energetyczną i odżywczą posiłków np. poprzez dodatek tłuszczów takich jak masło, oleje, oliwa, zmielone orzechy, żółtko jajka itp. Dodatkowo chory powinien móc spożywać posiłki zawsze kiedy ma na to ochotę.
Jeśli nie ma możliwości pokrycia zapotrzebowania energetycznego za pomocą zwykłej diety doustnej, należy włączyć produkty specjalnego przeznaczenia medycznego FSMP (ang. food for special medical purposes). Są one skoncentrowanym źródłem energii i składników odżywczych w małej objętości
Piśmiennictwo
- Kłęk S, Jankowski M, Kruszewski WJ, Fijuth J, Kapała A, Kabata P, Wysocki P, Krzakowski M, Rutkowski P.: Clinical Nutrition in Oncology: Polish Recommendations. Oncol. Clin. Pract. 2015; 11(4): 172–188.
- Kłęk S. i wsp.: Standardy Żywienia dojelitowego i pozajelitowego. POLSPEN. Scientifica, Kraków 2019.
- Kłęk S.: Leczenie żywieniowe w onkologii. Współczesne podejście. PZWL, Warszawa
- Dirix P, Nuyts S, Van den Bogaert W.: Radiation-induced xerostomia in patients with head and neck cancer: a literature review. Cancer. 2006; 107(11): 2525-34.
- Jankowski M, Kłęk S. (red.).: Terapia żywieniowa u chorych operowanych z powodu nowotworów złośliwych. Via Medica, Warszawa 2020.
- Brzegowy M, Maciejewska-Cebulak M, Turek K.: Nie daj się rakowi! Wsparcie żywieniowe w chorobie nowotworowej. Wydawnictwo M., Kraków, 2018.
- Hesketh PJ., Chemotherapy- induced nausea and vomiting. N. Engl. J. Med. 2008; 358(23): 2482-2494.
- Kris MG., Tonato M., Bria E., et al.: Consensus recommendations for the prevention of vomiting and nausea following high-emetic-risk chemotherapy. Support. Care Cancer 2011; 19(Suppl. 1): S25-S62.
- Zachwieja Z.: Leki i pożywienie – interakcje. MedPharm, Wrocław 2008.
- Faria A, Monteiro R, Azevedo I, Calhau C.: Pomegranate juice effects on cytochrome P450S expression: in vivo studies. J Med Food. 2007; 10(4): 643-9.
- Park SJ, Yeo CW, Shim EJ, Kim H. Pomegranate juice does not affect the disposition of simvastatin in healthy subjects Eur J Drug Metab Pharmacokinet, 2016;41(4):339-44.

Autor dr n. med. Magdalena Jodkiewicz | 6.06.2022 | Nowotwory
Skutki radioterapii
Radioterapia jest metodą leczenia miejscowego. Pojedynczy zabieg trwa krótko, ale terapia wymaga od kilku do nawet kilkudziesięciu powtórzeń. Powikłania po radioterapii w dużej mierze zależą nie tylko od ilości frakcji, ale również od zastosowanej dawki i mogą utrzymywać się nawet do 3. miesięcy po jej zakończeniu.
Podobnie, jak w przypadku radioterapii w obszarze głowy i szyi, napromienianie w obszarze miednicy i jamy brzusznej, stosowane m.in. w raku żołądka, odbytnicy, trzustki, szyjki macicy i prostaty, może skutkować dolegliwościami ze strony przewodu pokarmowego. Najczęściej pojawiającym się skutkiem ubocznym tego rodzaju leczenia są zaburzenia rytmu wypróżnień, w tym głównie biegunka. Napromienianie może przyczyniać się do uszkodzenia kosmków jelitowych błony śluzowej jelit, zmiany mikrobioty jelitowej, a nawet do zwłóknienia jelit. Inne często pojawiające się w trakcie i po zakończeniu radioterapii w obszarze miednicy i jamy brzusznej dolegliwości to: zaczerwienienie skóry w miejscu napromienianym, ból brzucha, uczucie wzdęcia, nudności (rzadziej wymioty), brak apetytu, zwiększona ilość gazów, śluz i krew w stolcu, a także ból i pieczenie przy oddawaniu stolca. Z tego powodu istotne jest wsparcie dietetyczne już na początku tego rodzaju leczenia.
Zalecenia dietetyczne w trakcie radioterapii w obszarze miednicy i jamy brzusznej
Z powodu dużego ryzyka wystąpienia biegunki na skutek radioterapii, już na początku napromieniania w obszarze jamy brzusznej i miednicy zalecenia dietetyczne opierają się na zasadach diety lekkostrawnej Dotyczy to głównie eliminacji pełnoziarnistych produktów zbożowych oraz surowych warzyw i owoców, które mogą nasilać pracę jelit i w konsekwencji przyczyniać się do wywołania biegunki. Podobne działanie mogą mieć ostre przyprawy (np. ostra papryka, chili, pieprz), których stosowanie w trakcie radioterapii w obszarze miednicy i jamy brzusznej jest niezalecane. Często już od początku radioterapii rekomenduje się zamianę nabiału na produkty bezlaktozowe. Zazwyczaj są one oznaczone na opakowaniach kolorem fioletowym. Nie ma jednak wskazań do całkowitej eliminacji nabiału z diety. Inną możliwością jest też zamiana produktów mlecznych na roślinne (sojowe, kokosowe, migdałowe, ryżowe itp.), które z natury nie zawierają laktozy. Jednak poza żywnością sojową większość z nich nie jest dobrym źródłem białka.
Czytaj także: Czy warto pić napoje roślinne?
Niekiedy, z powodu radioterapii w obszarze jamy brzusznej, chorym z ciężkim popromiennym zapaleniem jelit, dodatkowo zaleca się stosowanie diety bezglutenowej. Dieta ta jednak jest bardzo restrykcyjna i dedykowana nielicznym pacjentom. Zgodnie ze standardami leczenia żywieniowego w onkologii nie ma wskazań do profilaktycznego stosowania diety bezglutenowej w trakcie radioterapii w obszarze jamy brzusznej i miednicy. Wyjątkiem są chorzy z wcześniej rozpoznaną chorobą trzewną (celiakią).
Zalecenia dietetyczne przy biegunce
W przypadku wystąpienia biegunki w trakcie leczenia, oprócz kontynuacji stosowania diety lekkostrawnej należy zwiększyć ilość produktów zapierających. Należą do nich: biały ryż, płatki ryżowe, wafle ryżowe (z dodatkiem soli), ziemniaki, mąka ziemniaczana, kasza manna, czerstwe pieczywo pszenne i sucharki, produkty z mąki pszennej oczyszczonej, błyskawiczne płatki owsiane, gotowana marchewka, dynia, czarne jagody, niedojrzałe banany, mus jabłkowy lub pieczone jabłko, galaretki, kisiel oraz jaja na twardo. Konsekwencją biegunki jest odwodnienie i utrata elektrolitów, dlatego bardzo ważne jest właściwe nawodnienie, czyli wypijanie minimum 1,5-2 l płynów dziennie. Oprócz najczęściej zalecanej niegazowanej wody mineralnej wskazane jest też picie napojów o działaniu zapierającym, które są źródłem elektrolitów i garbników. Należą do nich: czarna herbata, napar z czarnych suszonych jagód, kakao na wodzie, buliony warzywne, sok pomidorowy z dodatkiem soli. Można też korzystać z doustnych płynów nawadniających (ORS, ang. oral rehydration salts), które można kupić w aptece lub samodzielnie przygotować w domu.
Jak przygotować domowy ORS?
Potrzebujemy:
- 1 l wody mineralnej
- ¼ łyżeczki soli
- 3 łyżki miodu lub cukru
Opcjonalnie można dodać sok z ½ pomarańczy, cytryny lub limonki
Dieta BRAT
Zgodnie z zaleceniami ekspertów, w polskich standardach leczenia żywieniowego w onkologii, przy uporczywych biegunkach zaleca się zastosowanie tzw. diety BRAT (ang. banana, rice, apple, toast), której nazwa pochodzi od pierwszych liter anglojęzycznych nazw najbardziej zapierających produktów spożywczych. Są to: niedojrzałe banany, biały (najlepiej rozgotowany) ryż, jabłko pieczone lub surowe starte, a także pszenne pieczywo i sucharki. Taka dieta nie jest pełnowartościowa, dlatego należy ją stosować krótkotrwale i pod kontrolą dietetyka. Po ustąpieniu biegunki należy wrócić do diety łatwostrawnej, a następnie rozszerzać ją zgodnie z tolerancją i preferencjami chorego.
Produkty niezalecane przy biegunce
Oprócz niezalecanych produktów wzdymających i wysokobłonnikowych, takich jak pełnoziarniste produkty zbożowe oraz surowe warzywa i owoce, w trakcie biegunki nie należy również pić i spożywać produktów o działaniu rozluźniającym. Należą do nich kawa, soki owocowe, a także suszone śliwki. W trakcie biegunki nie zaleca się też używania słodzików, w tym również takich jak ksylitol, erytrol/erytrytol, stewia.
Zaparcia przy radioterapii w obszarze miednicy i jamy brzusznej
Niekiedy, w trakcie radioterapii w obszarze jamy brzusznej i miednicy, problemem chorych są zaparcia. W tej sytuacji nie należy stosować diety wysokobłonnikowej, ponieważ może ona spowodować podrażnienie błony śluzowej jelit.
Dobrym początkiem postępowania dietetycznego w takiej sytuacji będzie odpowiednie nawodnienie (1,5-2 l wody niegazowanej dziennie) oraz włączenie do diety produktów i płynów o działaniu przeczyszczającym. Należą do nich między innymi ciepłe kompoty, najlepiej ze śliwek suszonych, które można też zjeść po wypiciu naparu, a także ciepłe soki owocowe (mogą być rozcieńczone z wodą), sok pomidorowy oraz sok z kiszonej kapusty lub kiszonych ogórków. Zamiast mocnych naparów z czarnej herbaty zaleca się picie herbaty zielonej, owocowej lub naparów z kopru włoskiego i rumianku, a także kleiku z siemienia lnianego. Działanie przeczyszczające ma również naturalna kawa, ale przed jej spożyciem należy ustalić czy nie ma innych przeciwwskazań do jej spożycia. W przypadku chorych zmagających się z zaparciami ciepłe napoje można pić z dodatkiem słodzików pochodzenia naturalnego, ponieważ cukier z brzozy (ksylitol) ma właściwości przeczyszczające.
W diecie chorego z zaparciami, w trakcie radioterapii w obszarze jamy brzusznej i miednicy, należy również uwzględnić naturalne, fermentowane produkty mleczne. Są one źródłem probiotyków, które zasiedlają jelito grube i w ten sposób poprawiają jego perystaltykę. Niezalecane są produkty o działaniu zapierającym (szczególnie te z diety BRAT oraz produkty wzdymające).Warto rozważyć też włączenie aktywności fizycznej, która pomoże w uregulowaniu motoryki jelit. Należy jednak pamiętać, aby była ona dostosowana do kondycji i możliwości chorego.
Dieta chorych w trakcie radioterapii wymaga modyfikacji wynikających ze skutków ubocznych leczenia oraz dolegliwości ze strony przewodu pokarmowego. Zazwyczaj nie jest możliwe stosowanie się do zasad zdrowego żywienia i spożywanie diety wysokobłonnikowej, bogatej w surowe warzywa i owoce oraz produkty pełnoziarniste. Z tego powodu przed rozpoczęciem leczenia dobrze jest zgłosić się do specjalisty w celu indywidualnego omówienia zaleceń dietetycznych na czas terapii.
Piśmiennictwo:
- Kłęk S., Jankowski M., Kruszewski W.J. et al.: Clinical Nutrition in Oncology: Polish Recommendations. Oncol. Clin. Pract. 2015, 11: 172–188.
- Muscaritoli M., Arends J., Bachmann P. et al.: ESPEN practical guideline: Clinical Nutrition in cancer. Clin. Nutr. 2021, 40(5): 2898–2913.
- Kłęk S. i wsp.: Standardy Żywienia dojelitowego i pozajelitowego. POLSPEN. Scientifica, Kraków, 2019.
- Prevention and Survival. Summary of Global Evidence on Diet, Weight, Physical Activity & What Increases or Decreases Your Risk of Cancer: World Cancer Research Fund International. Continuous Update Project: Cancer, April 2016 edition, http://www.uece.br/nutrindowp/wp-content/uploads/sites/82/2021/07/Dieta-e-C%C3%A2ncer-CUP-Summary-Report-2016.pdf.
- Kłęk S.: Leczenie żywieniowe w onkologii. Współczesne podejście, PZWL, Warszawa, 2020.
- Jankowski M., Kłęk S. (red.).: Terapia żywieniowa u chorych operowanych z powodu nowotworów złośliwych. Biblioteka Chirurga Onkologa, tom 15, Via Medica, Warszawa, 2020.
- Brzegowy M., Maciejewska-Cebulak M., Turek K.: Nie daj się rakowi! Wsparcie żywieniowe w chorobie nowotworowej. Wydawnictwo M, Kraków, 2018.

Autor dr n. med. Magdalena Jodkiewicz | 31.05.2022 | Nowotwory
Na czym polega radioterapia?
Napromienianie jest metodą leczenia miejscowego, stosowaną zarówno na ognisko pierwotne, jak i przerzuty w węzłach chłonnych czy kościach. Sam zabieg jest krótki i trwa najczęściej kilkanaście minut, ale zazwyczaj wymaga wielu powtórzeń (nawet kilkudziesięciu). Zalecona dawka napromieniania nie może być podana jednorazowo. Zabieg musi być frakcjonowany, czyli podzielony na mniejsze dawki. Podczas radioterapii organizm nie kumuluje dawki promieniowania, ale po pierwszych 2-3 tygodniach mogą pojawić się skutki uboczne w postaci odczynu popromiennego. Nasila się on wraz z trwającym leczeniem i często utrzymuje się do kilku tygodni po jego zakończeniu. Tkanki, które są wyjątkowo wrażliwe na napromienianie, to przede wszystkim: skóra, błona śluzowa jamy ustnej, gardła i krtani, jelita oraz płuca. Ze względu na duże ryzyko skutków ubocznych radioterapii istotne jest wsparcie żywieniowe już na początku leczenia. Pomoc dietetyczna jest szczególnie ważna m.in. w przypadku napromieniania nowotworów głowy i szyi.
Zalecenia dietetyczne w trakcie radioterapii okolicy głowy i szyi
Konsekwencją radioterapii okolicy głowy i szyi jest popromienny odczyn śluzówek i napromienianej skóry, co powoduje trudności i ból przy przełykaniu (dysfagia) oraz suchość w jamie ustnej (kserostomia). Dolegliwości te wpływają na zaburzenia smaku i utratę apetytu, co przyczynia się do ograniczania spożywanych posiłków i w konsekwencji może prowadzić do niedożywienia. Z tego powodu, aby zminimalizować powstawanie działań niepożądanych oraz nie podrażniać już uszkodzonej błony śluzowej jamy ustnej, chorym leczonym tą metodą zaleca się eliminację z diety:
-
- posiłków pikantnych, z dodatkiem ostrych przypraw (np. ostrej papryki, chili, pieprzu)
- posiłków kwaśnych, także tych zawierających kwasy owocowe
- posiłków gorących
- produktów twardych i chrupkich, takich jak krakersy, paluszki czy pieczywo chrupkie
- produktów panierowanych, smażonych i grillowanych z dodatkiem tłuszczu
- produktów marynowanych w occie, kiszonych oraz wędzonych
- surowych warzyw i owoców, z wyjątkiem banana i mango (owoce te nie są bardzo kwaśne, zazwyczaj są miękkie i łagodne w smaku, jednak decyzję o ich włączeniu do diety trzeba podejmować indywidualnie, w zależności od tolerancji wybranej żywności)
- pełnoziarnistych produktów zbożowych
Zalecana dieta powinna być lekkostrawna i wysokobiałkowa. Istotne jest odpowiednie nawadnianie, czyli ok. 1,5-2l niesłodzonych płynów takich jak woda mineralna niegazowana, czarna herbata, napar z lipy, nagietka czy melisy.
W praktyce pacjentom poddawanym radioterapii w obszarze głowy i szyi zaleca się spożywanie 6-8 mniejszych objętościowo posiłków.
Warzywa najlepiej spożywać w formie gotowanej. Dobrze tolerowane są: marchew, dynia, cukinia, kabaczki, buraki, korzeń pietruszki, ziemniaki, bataty, szpinak, kalafior, brokuł. Źle tolerowane są zazwyczaj: pomidory, surowa papryka, oliwki, kapary ponieważ mogą nasilać pieczenie i ból w jamie ustnej.
Działanie podrażniające błonę śluzową mogą mieć też produkty zbożowe pełnoziarniste, dlatego chorzy w trakcie radioterapii okolicy głowy i szyi powinni spożywać oczyszczone produkty zbożowe, takie jak pieczywo pszenne, biały ryż, drobne kasze i płatki oraz makarony pszenne ugotowane na miękko.
Płatki i kasze można rozmaczać i również należy gotować na miękko. Można też zmiksować je z posiłkiem. Podobnie pieczywo, które można namaczać w rosole lub mleku. W diecie należy ograniczyć produkty bogate w cukry proste, takie jak słodycze, słodkie napoje, dżemy, miód, dosładzany nabiał, ponieważ zwiększają one ryzyko rozwoju próchnicy.
Do każdego posiłku należy włączać produkty będące źródłem pełnowartościowego i dobrze przyswajalnego białka. Należą do nich chude i półtłuste gatunki mięsa, jaja, tłuste i chude gatunki ryb, galarety na żelatynie z dodatkiem mięs, jaj czy ryb, a także pełnotłuste mleko i fermentowane produkty mleczne, za wyjątkiem sera topionego i pleśniowego. Mięso i ryby powinny być ugotowane na miękko, najlepiej z dodatkiem śmietanki, sosów czy oleju/oliwy.
Ze względu na duże ryzyko utraty masy ciała w trakcie radioterapii okolicy głowy i szyi chorym rekomenduje się włączenie do diety naturalnych produktów spożywczych o dużej gęstości energetycznej. Zwiększy to wartość kaloryczną posiłku przy jego niezmienionej wielkości.
Do takich produktów należą: masło, śmietanka, oleje roślinne (najlepiej olej rzepakowy, olej lniany, oliwa z oliwek), awokado, zmiksowane orzechy, mleko kokosowe, żółtko jajka, tarty żółty ser itp. Kaloryczność posiłków można też zwiększyć poprzez ich zagęszczanie mąką pszenną, kokosową i ziemniaczaną, a także płatkami zbożowymi (błyskawicznymi) i kaszką manną.
Konsystencja diety
Zalecenia żywieniowe dla chorych w trakcie radioterapii głowy i szyi z trudnościami i bólem przy przełykaniu powinny uwzględniać nie tylko rodzaj produktów, ale także konsystencję diety. Jej zmiana ma na celu zminimalizowanie dolegliwości, poprawienie komfortu jedzenia oraz zapewnienie bezpiecznego połykania. Konsystencję diety dostosowuje się do stopnia nasilenia dysfagii. Zazwyczaj rozpoczyna się od diety miękkiej, następnie przecieranej (bardzo gęstej), zmiksowanej (umiarkowanie gęstej), aż do płynnej.
W praktyce u chorych borykających się z zapaleniem jamy ustnej po radioterapii proponuje się spożywanie: zmiksowanych zup mięsno-warzywnych i mlecznych, zup typu krem z warzyw, biszkoptów namoczonych w mleku, pełnotłustego nabiału (serki homogenizowane, jogurty, kefiry, maślanki, zsiadłe mleko, twaróg zmiksowany ze śmietanką itp.), budyniu, kisielu, galaretek oraz koktajli mleczno-owocowych (najlepiej z owoców łagodnych np. mango, banan). Zaleca się również spożywanie jajecznicy na parze, jajek na miękko, past jajecznych oraz puree z warzyw lub łagodnych w smaku owoców (bez pestek). Posiłki zmiksowane nie muszą być mdłe i niesmaczne, a sama konsystencja umożliwia „przemycenie” produktów o dużej wartości odżywczej.
Bezpieczne przełykanie
W przypadku zapalenia jamy ustnej będącej skutkiem radioterapii okolicy głowy i szyi nie poleca się spożywania produktów, które mogą zwiększać ryzyko zakrztuszenia się. Należą do nich produkty o mieszanej konsystencji takie jak: zupa z grzankami, produkty włókniste i łykowate, których przykładem może być ananas, mięso wołowe w kawałku czy fasolka szparagowa. Problematyczne mogą też być produkty suche np. krakersy i sucharki, a także produkty okrągłe lub podłużne, których przykładem mogą być winogrona oraz produkty wiotkie typu liść sałaty czy plaster ogórka. Częstą przyczyną zakrztuszenia mogą być również produkty sypkie takie jak: zioła suszone, kakao i cukier puder (szczególnie jeśli używane są w formie posypki na posiłku).
Suchość w jamie ustnej
Suchość w jamie ustnej, będąca skutkiem ubocznym radioterapii, jest spowodowana uszkodzeniem gruczołów ślinowych. Brak śliny utrudnia jedzenie, nasila ból podczas przełykania i zwiększa ryzyko rozwoju próchnicy. Przy kserostomii przeciwwskazane jest picie płynów, które wysuszają i działają drażniąco na błonę śluzową jamy ustnej oraz zmniejszają produkcję śliny. Do takich płynów należą mocne napary z kawy i herbaty oraz napoje gazowane. Podobnie jak przy zapaleniu jamy ustnej chorym rekomenduje się w tym wypadku stosowanie diet miękkich z dodatkiem sosów, a niekiedy płynnych. Należy unikać suchej żywności (wafle, chrupki itp.). Dodatkowo w celu zmniejszenia uczucia suchości w jamie ustnej zaleca się płukanie jamy ustnej naparami z nagietka, ssanie kostek lodu
i kwaśnych cukierków bez cukru oraz żucie gumy. Aby złagodzić występujące dolegliwości można spożywać kleik z siemienia lnianego. W przypadku braku poprawy po stosowaniu naturalnych metod można skorzystać z farmaceutycznych preparatów sztucznej śliny, które są dostępne w aptekach bez recepty.
Radioterapia w obszarze głowy i szyi bardzo szybko powoduje problemy z przyjmowaniem posiłków. Ze względu na to, w celu zapobiegania niedożywieniu, konieczne jest zastosowanie się do zaleceń dietetycznych już na początku leczenia i ewentualne modyfikowanie diety uwzględniające stopień zaburzeń połykania.
Piśmiennictwo:
- Kłęk S., Jankowski M., Kruszewski W.J. et al.: Clinical Nutrition in Oncology: Polish Recommendations. Oncol. Clin. Pract. 2015, 11: 172–188.
- Kawecki A., Nawrocki S. (red.): Nowotwory nabłonkowe narządów głowy i szyi. Zalecenia postępowania diagnostyczno-terapeutycznego w nowotworach złośliwych, 2014, online: http://onkologia.zalecenia.med.pl/pdf/zalecenia_PTOK_tom1_01_Nowotwory_nablonkowe_glowy_i_szyi_20140807.pdf.
- Muscaritoli M., Arends J., Bachmann P. et al.: ESPEN practical guideline: Clinical Nutrition in cancer. Clin. Nutr. 2021, 40(5): 2898–2913.
- Kłęk S. i wsp.: Standardy Żywienia dojelitowego i pozajelitowego. POLSPEN, Scientifica, Kraków, 2019.
- World Cancer Research Fund International. Continuous Update Project: Cancer Prevention and Survival Summary of Global Evidence on Diet, Weight, Physical Activity & What Increases or Decreases Your Risk of Cancer, 2016, online: http://www.uece.br/nutrindowp/wp-content/uploads/sites/82/2021/07/Dieta-e-C%C3%A2ncer-CUP-Summary-Report-2016.pdf.
- Kłęk S.: Leczenie żywieniowe w onkologii. Współczesne podejście, PZWL, Warszawa, 2020.
- Sroussi H., Epstein J., Bensadoun R. et al.: Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis. Cancer Med. 2017, 6(12): 2918–2931.
- Greco E., Simic T., Ringash J. et al.: Dysphagia Treatment for Patients With Head and Neck Cancer Undergoing Radiation Therapy: A Meta-analysis Review. Int. J. Radiat. Oncol. Biol. Phys. 2018, 10 (2): 421–444.
- Dirix P., Nuyts S., Van den Bogaert W.: Radiation-induced xerostomia in patients with head and neck cancer: a literature review. Cancer 2006, 107(11): 2525–34.
- Jankowski M., Kłęk S. (red.): Terapia żywieniowa u chorych operowanych z powodu nowotworów złośliwych. Biblioteka Chirurga Onkologa, Tom 15, Via Medica, Warszawa, 2020.
- Brzegowy M., Maciejewska-Cebulak M., Turek K.: Nie daj się rakowi! Wsparcie żywieniowe w chorobie nowotworowej, Wydawnictwo M, Kraków, 2018.

Autor dr n. med. Magdalena Jodkiewicz | 9.03.2022 | Nowotwory
Niedożywienie w onkologii
Terapia onkologiczna może przyczyniać się do ograniczenia spożywania posiłków, zaburzeń wchłaniania i/lub metabolizmu, co znacząco wpływa na odżywianie w chorobie nowotworowej. Żywienie w chorobie nowotworowej jest bardzo ważne gdyż wpływa na przebieg leczenia. Niedożywienie u chorych onkologicznych zwiększa ilość powikłań, wydłuża czas hospitalizacji, a w zaawansowanym stadium może spowodować odstąpienie od leczenia lub odroczenie terapii do czasu poprawy ogólnego stanu chorego. Szacuje się, że objawy niedożywienia mogą dotyczyć nawet 30 – 85% chorych, a najbardziej narażone są osoby z rozpoznaniem raka przełyku, żołądka, trzustki, a także nowotworów głowy i szyi oraz płuc. Nadmierna i niezamierzona utrata masy ciała związana z zaburzeniami odżywiania i niedożywieniem może prowadzić do rozwoju kacheksji nowotworowej (wyniszczenia), która tylko w niewielkim stopniu odpowiada na metody wsparcia żywieniowego.
Dieta w walce z rakiem – zalecenia. Co jeść w chorobie nowotworowej?
Poradnictwo dietetyczne u chorych onkologicznych jest najprostszą i najtańszą metodą na poprawę i utrzymanie prawidłowego stanu odżywienia. Korzystanie z takiej formy wsparcia zaleca się na każdym etapie leczenia, tj. od rozpoznania choroby, przez okres aktywnego leczenia, a także dla chorych paliatywnych oraz dla osób po zakończonym leczeniu onkologicznym, jako forma profilaktyki wtórnej. Właściwe wsparcie, które zapewnia dieta jest integralną częścią leczenia systemowego i zyskuje coraz więcej zwolenników w środowisku medycznym oraz instytucjach i towarzystwach naukowych. Zgodnie ze standardami leczenia żywieniowego pacjentów onkologicznych przygotowanymi przez ESPEN (Europejskie Towarzystwo Żywienia Klinicznego i Metabolizmu) poradnictwo dietetyczne ma najwyższy stopień wiarygodności „A” wg medycyny opartej na faktach (EBM ang. evidence based medicine).
Niezbędnym elementem konsultacji dietetycznej jest ocena stanu odżywienia, która powinna być przeprowadzona na podstawie dokładnego wywiadu żywieniowego. Następnie należy ustalić zapotrzebowanie na energię oraz poszczególne składniki odżywcze. Zgodnie z najnowszymi zaleceniami ESPEN z 2021 roku u chorych onkologicznych zaleca się, aby dobowa podaż energii wynosiła 25-30 kcal/kg aktualnej masy ciała/dobę, a podaż białka 1-1,5g/kg aktualnej masy ciała/dobę. Tłuszcz powinien stanowić nawet do 50% energii, co jest znacznie wyższym udziałem w diecie niż zaleca się u osób zdrowych. W przypadku chorych wyniszczonych wartości te mogą wzrastać. U chorych z nadwagą i otyłością zapotrzebowanie wylicza się na podstawie należnej masy ciała. Zapotrzebowanie chorych onkologicznych na mikroskładniki nie różni się od zapotrzebowania osób zdrowych i określane jest na podstawie zalecanego dziennego spożycia (RDA, ang. recommended dietary allowances). Zalecana ilość wody u osób, których masa ciała nie przekracza 70 kg, to 30-40ml/kg masy ciała/dobę. U ciężko chorych podaż wody powinna być ustalana na podstawie dobowego bilansu płynów.
Personalizacja diety
Dieta onkologiczna nie jest taka sama dla każdej osoby.
Zalecenia żywieniowe powinny być dostosowane indywidualnie, biorąc pod uwagę stan odżywienia, lokalizację i stopień zaawansowania nowotworu oraz dolegliwości ze strony przewodu pokarmowego i choroby towarzyszące.
Jadłospis w chorobie nowotworowej powinien uwzględniać preferencje żywieniowe chorego oraz możliwości spożycia.
Dietoterapia ma na celu zapobieganie niedożywieniu oraz zminimalizowanie odczuwania skutków ubocznych leczenia,
do których należą przede wszystkim nudności, wymioty, brak apetytu, jadłowstręt, biegunka, zaparcia, zmiany smaku, zapalenia błony śluzowej przewodu pokarmowego, pleśniawki, zwężenie przełyku. Część z tych dolegliwości może nasilać dysfagię (zaburzenia połykania), a niektóre nawet uniemożliwić doustne przyjmowanie posiłków. Bardzo często zalecenia dietetyczne dla chorych onkologicznych, w celu odciążenia przewodu pokarmowego, ułatwienia trawienia i wchłaniania składników odżywczych, oparte są na diecie łatwostrawnej. Do głównych zasad tej diety należy eliminacja potraw smażonych, większości surowych warzyw i owoców, pełnoziarnistych produktów zbożowych oraz produktów tłustych i wzdymających. W trakcie leczenia onkologicznego częstą koniecznością jest wzmacnianie diety produktami o wysokiej gęstości energetycznej. Należą do nich przede wszystkim łatwostrawne tłuszcze takie jak masło, słodka śmietanka, a także żółtko jajka, oleje roślinne oraz zmielone orzechy i migdały.
Produkty specjalnego przeznaczenia medycznego
W przypadku kiedy zapotrzebowanie energetyczne nie może być pokryte samą dietą kuchenną, potrzebne jest wsparcie produktami specjalnego przeznaczenia medycznego FSMP (ang. food for special medical purposes). Preparaty te są skoncentrowanym źródłem energii i składników odżywczych w małej objętości, mają różne formy (np. płynne lub proszek do rozpuszczenia w wodzie lub jedzeniu) oraz są dostępne bez recepty. Właściwy dobór preparatu powinien uwzględniać stan kliniczny chorego oraz choroby towarzyszące. Źle dobrany preparat może wywołać skutki uboczne np. w postaci biegunki, czy nudności i wymiotów. Przyczyną dolegliwości może też być nieprawidłowy sposób przyjmowania preparatu np. w sytuacji kiedy preparat jest wypity szybko lub jest zbyt zimny.
Poradnictwo dietetyczne jest ważnym elementem w procesie leczenia onkologicznego. Może przyczyniać się do poprawy stanu ogólnego i zmniejszenia ilości powikłań, a tym samym poprawiać jakość życia chorych. Każdy chory powinien mieć możliwość skorzystania z takiej porady już na początku leczenia, a następnie być monitorowany przez cały jego okres.
Piśmiennictwo
- Muscaritoli M., Arends J., Bachmann P. et al.: ESPEN practical guideline: Clinical Nutrition in cancer. Clin. Nutr. 2021, 40(5): 2898–2913.
- Kłęk S.: Leczenie żywieniowe w onkologii. Współczesne podejście., PZWL, 2020.
- Kłęk S. i wsp.: Standardy Żywienia dojelitowego i pozajelitowego. POLSPEN Scientifica, Kraków, 2019.
- World Cancer Research Found International. Continous Update Project: Cancer Prevention and Survival Summary of Global Evidence on Diet, Weight, Physical Activity & What Increases or Decreases Your Risk of Cancer, 2016.
- Kłęk S., Jankowski M., Kruszewski W.J. i wsp.: Clinical Nutrition in Oncology: Polish Recommendations. Oncol. Clin. Pract. 2015, 11: 172–188.

Autor mgr inż. Paula Nagel | 2.01.2019 | Choroba a dieta, Choroby układu pokarmowego, Inne, Nowotwory, Praktyczne porady, Skuteczne odchudzanie, Zasady zdrowego żywienia, Żywienie osób w wieku starszym
Lekko i strawnie
Dieta łatwostrawna jest prostą modyfikacją żywienia podstawowego. Powinna dostarczać taką samą ilość energii i wszystkich składników odżywczych jak jest to w przypadku diety osób zdrowych. Różnica polega na spożywaniu pokarmów łatwo ulegających trawieniu, nieobciążających przewodu pokarmowego. Stosując dietę lekkostrawną wyklucza się produkty bogate w błonnik pokarmowy (bogatoresztkowe), wzdymające czy nasączone tłuszczem. Unika się też stosowania ostrych przypraw takich jak sól, pieprz, ocet, ostra papryka. Najczęściej dieta lekkostrawna stosowana jest:
- w chorobach żołądka i jelit (np. w chorobie Leśniowskiego-Crohna, zapaleniu błony śluzowej jelit, nieżycie żołądka),
- chorobach przyzębia (np. erozja zębów, paradontoza),
- nowotworach przewodu pokarmowego (np. rak jelita grubego),
- w okresie rekonwalescencji po zabiegach chirurgicznych (np. po zabiegach bariatrycznych),
- chorobach infekcyjnych przebiegających z gorączką,
- w żywieniu osób w wieku podeszłym.
Ograniczenie błonnika
Błonnik pokarmowy w wyniku zdolności wiązania wody i pęcznienia zalega w przewodzie pokarmowym dając dłuższe uczucie sytości. W przypadku osób z chorobami żołądka czy jelit jest to niewskazane, natomiast z fizjologicznego punktu naszego organizmu całkowita rezygnacja z błonnika pokarmowego jest niepożądana. Włókno (błonnik) pokarmowe stymuluje procesy fermentacyjne w jelicie grubym, dzięki czemu tworzy odpowiednie podłoże dla rozwoju korzystnej mikroflory bakteryjnej. Zdolność wiązania wody usprawnia wydalanie treści pokarmowej z przewodu pokarmowego i toksycznych produktów przemiany materii. Zaleca się, aby w diecie lekkostrawnej znalazła się minimalna zawartość błonnika pokarmowego w ilości 25g/ dobę/ osobę.
Istnieją pewne techniki kulinarne, dzięki którym błonnik staje się lepiej przyswajalny. Owoce i warzywa powinniśmy wybierać młode i delikatne, a te dojrzałe obierać ze skórki. W przypadku produktów zbożowych należy wybierać te o średnim stopniu przemiału (drobno i średniozmielone produkty zbożowe, np. pieczywo pszenne, sucharki, kasza kuskus). Dłuższy czas gotowania (rozgotowywanie), rozdrabianie, przecieranie przez sito także zmniejsza ilość błonnika w żywności. Soki i przeciery samodzielnie przygotowane będą dobrą alternatywą dla całych warzyw i owoców.
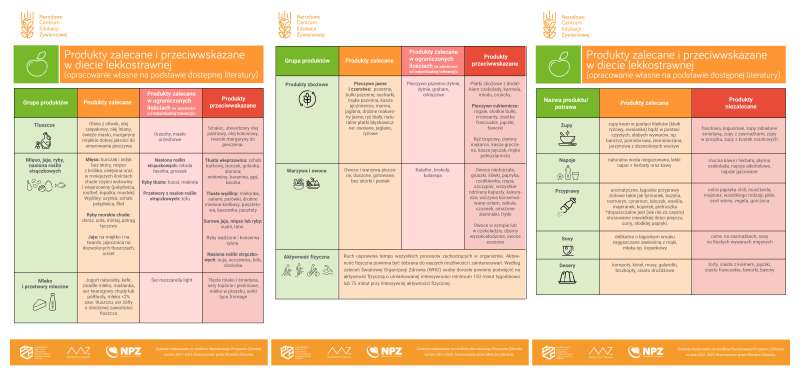
Jak przyrządzać potrawy na diecie lekkostrawnej?
Termin „łatwostrawna” jest często rozumiany przez pacjentów jako szybka obróbka kulinarna (np. smażenie), jednak jest to błędne rozumowanie. Aby nie obciążać przewodu pokarmowego zalecaną metodą przygotowywania potraw jest przede wszystkim gotowanie w wodzie lub na parze, duszenie bez obsmażania oraz pieczenie w folii, pergaminie lub naczyniach ceramicznych.
Wybór odpowiedniej metody przygotowania posiłku może poprawić albo obniżyć strawność przygotowanej potrawy. Proces gotowania potrafi znacząco obniżyć zawartość błonnika pokarmowego. Dla przykładu: 100 g surowego kalafiora zawiera 2,4 g/ błonnika, natomiast kalafior gotowany w wodzie zawiera 1,8 g/błonnika. Nie tylko gotowanie potraw czy miksowanie powoduje, że potrawa i zawarte w niej składniki odżywcze są łatwiej dostępne dla enzymów trawiennych. Dodatek ubitej piany z białek do budyniu, czy namoczona bułka do dań mięsnych rozpulchnia i zmiękcza potrawę, co ułatwia jej strawienie.
Na diecie lekkostrawnej niedozwolone są potrawy smażone, wędzone, peklowane. Są ciężkostrawne i dłużej zalegają w przewodzie pokarmowym, dlatego powinny zostać całkowicie wykluczone. Do zagęszczania zupy należy używać zawiesiny z mąki i mleka lub niewielką ilość masła, oleju bądź mleka. Tłuste zasmażki z mąki będą negatywnie wpływać na pracę przewodu pokarmowego i mogą objawiać się dolegliwościami bólowymi. Racjonalnie rozłożone mniejsze posiłki spożywane częściej, pozwalają na mniejsze wyrzuty insuliny, skracają uczucie głodu i mniej obciążają żołądek. Dostarczanie składników pokarmowych w mniejszych ilościach, ale częściej powoduje, że są lepiej wchłaniane i wykorzystywane przez organizm. Zalecane jest spożywanie 4-6 posiłków w ciągu dnia. Ostatni posiłek powinno się spożywać minimum 2 godziny przed pójściem spać.
Wymienione produkty w tabeli są dobrze tolerowane przez większość chorych, jednak zalecenia mogą się różnić w zależności od indywidualnej tolerancji pacjenta na dany produkt. Przykładem może być mleko i orzechy. Mleko u części pacjentów może być przyczyną biegunek, a z kolei orzechy często są wykluczane w żywieniu seniorów. Jednak, nie ma to uzasadnienia jeśli osoby starsze nie mają problemów z ich gryzieniem i trawieniem.

- Jarosz M. (red.) Zasady prawidłowego żywienia chorych w szpitalach. Instytut Żywności i Żywienia. Warszawa;2011.
- Jarosz M. (red.) Dietetyka. Żywność, żywienie w prewencji i leczeniu. Instytut Żywności i Żywienia. Warszawa; 2017.
- Kunachowicz H., Nadolna I., Przygoda B., Iwanow K.: Tabele składu i wartości odżywczej żywności. Wydawnictwo Lekarskie PZWL. Warszawa; 2017.

Autor mgr inż. Paula Nagel | 7.08.2018 | Choroba a dieta, Nowotwory
Znaczenie tłuszczu dla organizmu pacjenta onkologicznego
Tłuszcze stanowią podstawowe źródło energii dla organizmu – 1 g tłuszczu dostarcza 9 kcal, czyli ponad 2 razy więcej niż ta sama ilość węglowodanów czy białka. To w nich rozpuszczają się takie witaminy jak A, D, E i K. Tłuszcze pełnią też funkcje strukturalne i budulcowe oraz są niezbędne do syntezy wielu substancji biologicznie czynnych np. eikozanoidów – związków będących produktami przemian niezbędnych nienasyconych kwasów tłuszczowych (NNKT), które wykazują działanie przeciwzapalne. Kwasy tłuszczowe są podstawowym składnikiem układu nerwowego. Wyniki badań przeprowadzonych w ostatnim czasie wskazują, że osoby regularnie spożywające w diecie odpowiednią ilość NNKT rzadziej doświadczają zaburzeń w funkcjonowaniu mózgu, w tym depresji i chorób neurodegeneracyjnych.
Tłuszcz w organizmie zmagazynowany jest także w postaci tkanki tłuszczowej i pełni funkcję zapasową. Nie tylko chroni ciało przed zimnem i osłania narządy wewnętrzne przez urazami, ale przede wszystkim umożliwia przeżycie nawet, gdy okresowo zmniejszamy ilość pożywienia. W przypadku deficytu energii z diety organizm w pierwszej kolejności mobilizuje właśnie te zapasy, a gdy są one niewystarczające sięga po beztłuszczową masę ciała. W trakcie choroby nowotworowej zwiększa się zapotrzebowanie na energię z pożywienia, dlatego aby uniknąć wyniszczenia organizmu, bardzo ważne jest dostarczenie odpowiedniej ilości wszystkich składników odżywczych (białka, tłuszczu, węglowodanów, witamin i składników mineralnych).
Warto pamiętać, że tłuszcz jest również nośnikiem smaku, a w przebiegu choroby nowotworowej u części pacjentów dochodzi do obniżenia apetytu, więc dodatek tłuszczu nie powinien być pomijany w ich jadłospisie. Jednak tłuszcz tłuszczowi nierówny i nie tylko jego ilość, ale i jakość ma ogromne znaczenie w diecie chorego na nowotwór.
Podział tłuszczów i źródła w żywności
Ze względu na pochodzenie tłuszcze dzielimy na zwierzęce i roślinne. Tłuszcze zwierzęce w naszej diecie pochodzą głównie z mleka oraz z tkanki tłuszczowej, a także z mięsa zwierząt (np. masło, śmietana, sery, smalec, słonina, mięso). Zawierają one znaczną ilość cholesterolu i kwasów tłuszczowych nasyconych, dlatego ich spożycie należy ograniczać. Nadmiar tłuszczów zwierzęcych w diecie jest związany z ryzykiem wielu chorób, w tym: nadwagi i otyłości, chorób układu sercowo-naczyniowego, cukrzycy typu 2, nowotworów złośliwych.
Tłuszcze roślinne znajdują się m.in. w olejach roślinnych, margarynach, orzechach, nasionach, ziarnach, kakao, awokado, oliwkach. Tłuszcze roślinne wywierają korzystny wpływ na organizm, nie zawierają cholesterolu, są głównym źródłem jedno- i wielonienasyconych kwasów tłuszczowych, mają też mniejszy udział kwasów tłuszczowych nasyconych. To one powinny przeważać w diecie. Szczególnie wartościowe są olej rzepakowy i lniany, w których znajdują się cenne kwasy tłuszczowe omega-3. Natomiast olej słonecznikowy, sojowy czy kukurydziany to przede wszystkim źródło kwasów tłuszczowych omega-6. Wyjątkami wśród tłuszczów roślinnych są olej palmowy i kokosowy, ponieważ zawierają głównie kwasy tłuszczowe nasycone, których ilość w diecie należy ograniczać.
Tłuszcze dzielą się też na widoczne i niewidoczne. Masło, smalec czy olej zaliczamy do grupy tłuszczów widocznych, a tłuszcze niewidoczne występują np. w mleku, mięsie, słodyczach, słonych przekąskach czy potrawach fast-food. Problemem są niewidoczne nasycone kwasy tłuszczowe występujące w produktach przetworzonych np. tłustych wędlinach typu kiełbasy, parówki, salceson oraz izomery trans kwasów tłuszczowych, występujące np. w daniach w proszku, wyrobach cukierniczych, twardych margarynach stosowanych do pieczenia. Spożywanie produktów zawierających tłuszcze trans może być przyczyną zmian miażdżycowych, zwiększać ryzyko rozwoju cukrzycy typu 2 oraz potęgować stan zapalny w organizmie chorego na nowotwór.
Do zapamiętania – tłuszcze nienasycone nad nasyconymi
W zależności od budowy, kwasy tłuszczowe dzieli się na:
- kwasy tłuszczowe nasycone (SFA, ang. saturated fatty acid),
- jednonienasycone (MUFA, ang. monounsaturated fatty acids)
- wielonienasycone (PUFA, ang. polyunsaturated fatty acids).
Tłuszcze zwierzęce (masło, smalec, słonina) i oleje tropikalne (olej palmowy, olej kokosowy) są bogatym źródłem nasyconych kwasów tłuszczowych: laurynowego, mirystynowego, palmitynowego i stearynowego. Są one syntetyzowane w organizmie i nie muszą być dostarczane z pożywieniem.
Głównym przedstawicielem MUFA jest kwas oleinowy z rodziny omega-9 występujący w dużej ilości w oliwie z oliwek. Z kolei przedstawicielem kwasów wielonienasyconych PUFA z rodziny omega-6 jest kwas linolowy (LA) obecny w oleju słonecznikowym, kukurydzianym czy sojowym, a z rodziny omega-3 kwas dokozaheksaenowy (DHA) i kwas eikozapentaenowy (EPA), których najlepszym źródłem są olej lniany, rzepakowy i tłuste ryby morskie. Ważne jest, aby utrzymać odpowiednią proporcję między kwasami tłuszczowymi z rodziny omega-6 i omega-3 (4-5:1). Nadmierny udział w diecie kwasów omega-6 w stosunku do omega-3 jest niekorzystna dla organizmu – może prowadzić do namnażania się komórek nowotworowych i nasilenia stanu zapalnego. W diecie chorego na nowotwór powinny przeważać nienasycone kwasy tłuszczowe nad kwasami nasyconymi. Nienasycone kwasy tłuszczowe mają udokumentowane działanie przeciwzapalnie („prowygaszenione”), wzmacniające system immunologiczny człowieka. Chronią przed uszkodzeniami zdrowe komórki i pobudzają zaprogramowaną śmierć komórek nowotworowych na każdym etapie procesu powstawania nowotworu. Przybywa badań naukowych, których wyniki potwierdzają, że niezbędne nienasycone kwasy tłuszczowe (w szczególności wielonienasycone kwasy tłuszczowe omega-3) mogą obniżać wytwarzanie cytokin prozapalnych i zmniejszać skutki uboczne chemio- czy radioterapii. Daje to obiecujące prognozy na przyszłość w leczeniu nowotworów, ponieważ przekłada się nie tylko na większe szanse przeżycia chorych, ale i na polepszenie ich ogólnej jakości życia.
Oleje roślinne – tłuszcze o super mocy
W olejach roślinnych takich jak rzepakowy, lniany czy oliwa z oliwek dominują niezbędne nienasycone kwasy tłuszczowe, czyli te, których organizm pacjenta onkologicznego najbardziej potrzebuje do walki z chorobą (tabela 1). Wiele badań naukowych podkreśla prozdrowotne właściwości jedno- i wielonienasyconych kwasów tłuszczowych. Głównym komponentem oleju lnianego jest kwas α-linolenowy (ALA), którego zawartość sięga 60%. Tłuszcze zawarte w ziarnach lnu wykazują działanie profilaktyczne u kobiet zagrożonych rakiem piersi i prawdopodobnie mogą zmniejszać ryzyko śmiertelności wśród kobiet, które już zachorowały na ten nowotwór. Olejem o najkorzystniejszym stosunku omega-6 do omega-3 jest olej rzepakowy tłoczony na zimno (2,3:1). Jednonienasycone kwasy tłuszczowe stanowią w nim około 63%, a wielonienasycone kwasy tłuszczowe około 31%. W oliwie z oliwek głównym komponentem są kwasy tłuszczowe MUFA i występują w ilości aż 80%. Dodatkowo, w oliwie z oliwek występuje oleuropeina – związek fenolowy wykazujący silne działanie przeciwutleniające. W 2014 roku w prestiżowym czasopiśmie Nutrition and Cancer, opublikowano wyniki badań dowodzące, że ekstrakt z oliwy z oliwek z pierwszego tłoczenia hamuje namnażanie komórek nowotworowych w jelicie grubym. Inne doniesienia potwierdziły, że oleuropeina powoduje utratę żywotności komórek nowotworowych w obrębie sutka i prostaty. Oleje roślinne to także źródło innych bioaktywnych substancji hamujących powstawanie wolnych rodników: steroli wolnych, skwalenu, karotenoidów i chlorofilu.
Tabela 1. Wybrane oleje roślinne zalecane w diecie pacjenta onkologicznego (opracowanie własne)
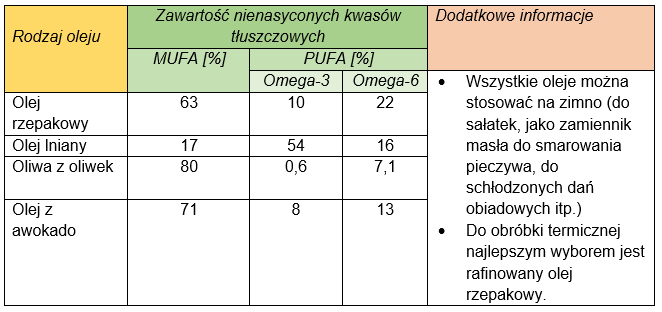
Oleje roślinne w diecie chorego na nowotwór z powodzeniem można dodawać do zup, koktajli, musów, past kanapkowych, sałatek, dipów czy sosów. Ponadto dobrym źródłem długołańcuchowych kwasów tłuszczowych PUFA są także tłuste ryby morskie, orzechy, nasiona siemienia lnianego, sezamu oraz glony. Orzechy i nasiona można zmielić i dodawać do potraw. Siemię lniane może być stosowane także w postaci kisielu z nasion czy dodatku do owsianki.
Czytaj więcej:
Zalecenia i przeciwwskazania dietetyczne w chorobach nowotworowych, mgr inż. Iwona Sajór
Dlaczego nie smażyć na oleju lnianym?, mgr inż. Wiktor Łazowski
Przeciwnowotworowe działanie kwasów tłuszczowych, mgr inż. Edyta Jasińska-Melon
e-Baza Izomerów Trans
- Morland S.L., Martins J.B., Mazurak V.C.: n-3 polyunsaturated fatty acid supplementation during cancer chemotherapy. Journal of Nutrition & Intermediary Metabolism; 2016. 5. 107-11.
- Paixão E.M., Oliveira A.C., Ito M.K. et. al.: The effects of EPA and DHA enriched fish oil on nutritional and immunological markers of treatment naïve breast cancer patients: a randomized double-blind controlled trial, Nutr J.; 2017. 23. 16(1). 71.
Mocellin M.C. i wsp.: A systematic review and meta-analysis of the n-3 polyunsaturated fatty acids effects on inflammatory markers in colorectal cancer, Clin Nutr; 2016. 35(2). 359-369.
- Pampaloni B. i wsp.: In vitro effects of extracts of extra virgin olive oil on human colon cancer cells. Nutrition and Cancer; 2014. 66. 7.
- Obiedzińska A., Waszkiewicz-Robak B.: Oleje tłoczone na zimno jako żywność funkcjonalna. Żywność. Nauka. Technologia. Jakość; 2012. 1 (80). 27-44.
- LeGendre O. i wsp., Oleocanthal rapidly and selectively induces cancer cell death via lysosomal membranepermeabilization, Mol Cell Oncol; 2015. 2(4). e1006077.
- Marciniak-Łukasik K., Rola i znaczenie kwasów tłuszczowych omega-3. Żywność. Nauka. Technologia. Jakość; 2011. 6 (79). 24-35.
- [online].[przeglądany: 10.07.2018]. Dostępny w: https://poznajsienatluszczach.pl.

Autor mgr inż. Iwona Sajór | 27.02.2018 | Choroba a dieta, Nowotwory
Aflatoksyny – czym są, jak wpływają na organizm i gdzie mogą występować?
Aflatoksyny to substancje produkowane przez grzyby pleśniowe z rodziny Aspergillus. Zarodniki grzybów roznoszone są przez wiatr lub owady i w ten sposób trafiają do upraw rolnych, a następnie do magazynów. Strzępki grzybów Aspergillus mogą przenikać także bezpośrednio do rozwijających się nasion rośliny przez niewielkie uszkodzenia w jej tkance. Szczególnie szybko rozwijają się w regionach tropikalnych i subtropikalnych, gdzie panuje optymalna dla ich rozwoju wilgotność powietrza oraz temperatura. Jednak ze względu na powszechną wymianę handlową produktów spożywczych pomiędzy różnymi krajami świata, łatwo dochodzi do rozprzestrzeniania się pleśni. Zakres temperatur, w których mogą rozwijać się grzyby Aspergillus, jest szeroki i wynosi od 12 do 40-42oC.
Aflatoksyny produkowane przez grzyby są toksyczne, przyczyniają się do powstawania wolnych rodników tlenowych, mogą powodować wady w rozwoju płodu, mutacje genów, uszkodzenia wątroby, nerek, układu nerwowego i odpornościowego. Sprzyjają powstawaniu raka wątroby, w związku z tym zostały zakwalifikowane przez Międzynarodową Agencję Badań nad Rakiem (IARC, International Agency for Research on Cancer) do karcinogenów grupy 1.
Rakotwórcze aflatoksyny najczęściej występują w niewłaściwie przechowywanych ziarnach zbóż, nasionach roślin strączkowych, orzechach, suszonych owocach (figach, rodzynkach), olejach roślinnych i przyprawach (pieprz, papryka, gałka muszkatołowa, imbir, kurkuma). Zdarza się, chociaż zdecydowanie rzadziej, że ich obecność wykrywana była również w mięsie, jajach i mleku zwierząt karmionych zanieczyszczoną paszą. W Polsce zanieczyszczone aflatoksynami są najczęściej produkty pochodzące z importu – orzechy arachidowe i brazylijskie, pistacje, kukurydza i ryż oraz produkty z nich wytwarzane (masło orzechowe, mąka, ciastka, płatki zbożowe itp.).
Jak zminimalizować ryzyko uszkodzenia wątroby przez aflatoksyny?
Całkowita eliminacja toksyn produkowanych przez grzyby Aspergillus z upraw rolnych nie jest możliwa, ponieważ wykazują one dużą trwałość i odporność na degradację (nie ulegają zniszczeniu pod wpływem wysokiej temperatury). W Polsce oraz w pozostałych krajach Unii Europejskiej działa system monitoringu oparty o rutynowe badania stężenia aflatoksyn w produktach rolnych i żywnościowych. Pozwala to minimalizować potencjalne ryzyko zdrowotne dla populacji UE związane z ich spożyciem.
Bardzo ważne są również działania profilaktyczne podejmowane przez nas indywidualnie. Kupując produkty zbożowe, orzechy czy suszone owoce, należy wybierać produkty pochodzące od sprawdzonych i renomowanych producentów żywności, a następnie przechowywać je w odpowiednich warunkach podanych na opakowaniu (unikać wilgotnych i ciepłych miejsc). Przy zakupie tego typu produktów warto sprawdzać, w jaki sposób są przechowywane w sklepie, m.in. czy opakowanie jest suche, czy znajduje się w chłodnym miejscu, czy opakowanie jest szczelne i nie ma śladów mechanicznego uszkodzenia. Produkty szczególnie narażone na rozwój pleśni najlepiej kupować na bieżąco, nie robić dużych zapasów.
Gdy mamy podejrzenie w stosunku do produktu (np. chleb z ziarnami lub pojedyncze orzechy w opakowaniu mają nieco zmieniony smak lub zapach), należy wyrzucić go w całości. Na nic nie zdają się próby ratowania części produktu zaatakowanego przez pleśnie – aflatoksyny choć niewidoczne i niewyczuwalne, znajdują się w całym produkcie. Orzechy, suszone owoce, nasiona roślin strączkowych czy inne ziarna (słonecznika, dyni, siemienia lnianego) należy kupować w opakowaniach jednostkowych. Przeciwwskazane jest zaopatrywanie się w te produkty na bazarach czy u innych sprzedawców, gdzie są one w formach nieporcjowanych („na wagę”), gdyż mogą pochodzić z nieprzebadanych źródeł i zawierać duże stężenie rakotwórczych aflatoksyn. Te same zasady dotyczą zakupów dokonywanych podczas wyjazdów zagranicznych.
Czytaj więcej:
Spożycie mięsa a ryzyko nowotworów
Zalecenia i przeciwskazania dietetyczne w chorobach nowotworowych
Jak żywienie i aktywność fizyczna pomaga w leczeniu nowotworów złośliwych
- World Cancer Research Fund International: The Associations between Food, Nutrition and Physical Activity and the Risk of Liver Cancer, London, 2015.
- WCRF/AICR Systematic Literature Review, Continuous Update Project Report, Diet, nutrition, physical activity and liver cancer, 2015 http://www.wcrf.org/sites/default/files/Liver-Cancer-2015-Report.pdf – dostęp 06.11.2017.
- Strona internetowa World Cancer Research Found http://www.wcrf.org/int/research-we-fund/continuous-update-project-findings-reports/liver-cancer – dostęp 06.11.2017.
- Kowalska A., Walkiewicz K. Kozieł P. i wsp.: Aflatoksyny – charakterystyka i wpływ na zdrowie człowieka. Postępy Hig. Med. Dosw., 2017, 71, 315-327.
- Liu Y., Chang C.C., Marsh G.M., et al.: Population attributable risk of aflatoxin-related liver cancer: systematic review and meta-analysis. Eur J Cancer, 2012, 48, 2125-2136.

Autor mgr inż. Iwona Sajór | 19.02.2018 | Choroba a dieta, Nowotwory
Miejsce czerwonego i przetworzonego mięsa w klasyfikacji czynników rakotwórczych
Zacznijmy od definicji. Mięso czerwone pochodzi od zwierząt rzeźnych (wieprzowina, wołowina, cielęcina, baranina, jagnięcina, konina, koźlina, dziczyzna) i charakteryzuje się wysoką zawartością żelaza hemowego. Natomiast mięso przetworzone to takie, które zostało poddane obróbce termicznej (np. przedłużonemu smażeniu, tradycyjnemu grillowaniu, wędzeniu), soleniu, peklowaniu, marynowaniu, fermentacji (dojrzewaniu) lub innym procesom polepszającym smak lub wydłużającym okres przydatności do spożycia.
W 2015 r. Międzynarodowa Agencja Badań nad Rakiem (IARC, International Agency for Research on Cancer) opublikowała raport podsumowujący wyniki ponad 800 badań z ostatnich 20 lat, dotyczących związku pomiędzy spożyciem mięsa a częstością występowania raka. Stwierdzono w nim, że regularne spożywanie wieprzowiny, wołowiny i innych gatunków czerwonego mięsa może być przyczyną rozwoju nowotworów. Czerwone mięso zostało zakwalifikowane do grupy 2A, w której znajdują się czynniki prawdopodobnie rakotwórcze dla człowieka i z pewnością rakotwórcze dla zwierząt laboratoryjnych, m.in. akryloamid, azotany i azotyny. Zależność pomiędzy spożyciem czerwonego mięsa a występowaniem nowotworów zaobserwowano dla raka jelita grubego, trzustki i gruczołu krokowego. Dane sugerują, że ryzyko jest najwyższe dla raka jelita grubego – na każde 100 gramów (porcja wielkości ½ dłoni) mięsa czerwonego spożywanego dziennie zwiększa się o 17%.
Mięso przetworzone okazało się jeszcze silniejszym karcinogenem i zostało zaklasyfikowane do grupy 1 – czynników, co do których istnieją przekonujące dowody, że są rakotwórcze dla człowieka. W tej grupie znajdują się między innymi alkohol, tytoń, azbest, aflatoksyny, zakażenie Helicobacter pylori. Wyniki badań wskazują, że częste spożywanie mięsa przetworzonego przyczynia się do rozwoju raka jelita grubego. Codzienne spożywanie 50 gramów mięsa przetworzonego (np. 2 duże plastry szynki wędzonej) zwiększa ryzyko zachorowania na raka jelita grubego o 18%. Obserwowano również podobny związek z rakiem żołądka, ale dowody w tym zakresie nie są wystarczająco jednoznaczne.
Potencjalne mechanizmy rozwoju nowotworów związane ze spożyciem mięsa
Dokładny mechanizm karcinogennego wpływu mięsa czerwonego i przetworzonego na organizm człowieka nadal jest wyjaśniany. Obecnie uważa się, że są za to odpowiedzialne substancje powstające w wyniku przemian żelaza hemowego, obecnego w dużej ilości w mięsie czerwonym, ponieważ uszkadzają DNA komórek organizmu człowieka. Dodatkowo obróbka termiczna mięsa w wysokiej temperaturze lub w bezpośrednim kontakcie z płomieniem (pieczenie na ruszcie) lub gorącą płytą grzejną (grillem, patelnią) powoduje powstawanie rakotwórczych substancji chemicznych (np. wielopierścieniowych węglowodorów aromatycznych i heterocyklicznych amin aromatycznych). Zatem, im bardziej spieczona powierzchnia mięsa, tym więcej szkodliwych karcinogenów w potrawie. Nie ma natomiast danych dotyczących bezpieczeństwa spożywania surowego mięsa w odniesieniu do rakotwórczości. W przypadku wędlin, ich wpływ na powstawanie nowotworów związany jest z dodatkiem azotanów i azotynów, które mogą reagować ze składnikami mięsa, tworząc rakotwórcze nitrozoaminy.
Bezpieczeństwo spożywania mięsa czerwonego i przetworzonego – rekomendacje
Według szacunków Global Burden of Disease Project, ok. 34 000 zgonów na nowotwory rocznie na świecie jest rezultatem diety bogatej w mięso przetworzone. Natomiast łączny efekt spożywania mięsa czerwonego i przetworów mięsnych jest szacowany na ok. 50 000 zgonów rocznie na świecie. Dla porównania: 1 mln zgonów na nowotwory rocznie na całym świecie następuje w wyniku palenia tytoniu, 600 000 zgonów rocznie z powodu spożycia alkoholu i ponad 200 000 zgonów rocznie z powodu zanieczyszczenia powietrza.
Można stwierdzić zatem, że dla pojedynczych osób ryzyko rozwoju raka jelita grubego związane ze spożywaniem mięsa czerwonego i przetworzonego wciąż pozostaje niewielkie. Nie wolno jednak zapominać, że ryzyko zachorowania na nowotwór rośnie wraz z ilością spożywanego mięsa. Co to oznacza w praktyce? Mięso czerwone jest źródłem wielu cennych dla zdrowia składników odżywczych i może stanowić uzupełnienie diety. Jednak osoby spożywające głównie wieprzowinę, wołowinę, cielęcinę, baraninę i inne gatunki czerwonego mięsa powinny ograniczyć ich ilość. Światowa Fundacja Badań nad Rakiem (WCRF, World Cancer Research Found) zaleca, aby nie przekraczać ilości 500 gramów czerwonego mięsa na tydzień (750 gramów przed przygotowaniem). Równie ważne jest to, że powinno być ono w jak najmniejszym stopniu przetworzone, czyli najlepiej gotowane, duszone bez obsmażania albo pieczone w folii lub naczyniu żaroodpornym.
W stosunku do mięsa czerwonego rekomendacja brzmi: „ogranicz”, natomiast w przypadku mięsa przetworzonego: „unikaj”. Jeszcze dokładniej powinny przyjrzeć się swojej codziennej diecie osoby obciążone rodzinnie rakiem jelita grubego. Zdecydowanie częściej zamiast mięsa czerwonego i przetworzonego powinny wybierać dania z udziałem ryb, drobiu, jaj i nasion roślin strączkowych. Warto także pamiętać, że czynnikiem działającym ochronnie w przypadku tego nowotworu, jest dieta bogata w błonnik pokarmowy zawarty w warzywach, owocach, pełnoziarnistych produktach zbożowych i roślinach strączkowych. Produkty te powinny dominować w naszej codziennej diecie.
- IARC Monographs evaluate consumption of red meat and processed meat, 240, 26.10.2015 https://www.iarc.fr/en/media-centre/pr/2015/pdfs/pr240_E.pdf
- WHO, IARC Monographs on the Evaluation of Carcinogenic Risk to Humans, http://monographs.iarc.fr/ENG/Classification/latest_classif.php – dostęp 03.11.2017
- Global Burden of Disease Cancer Collaboration. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life years for 32 cancer groups, 1990 to 2015: a systematic analysis for the Global Burden of Disease study. JAMA Oncology. 3, 2016, doi:10.1001/jamaoncol.2016.5688.
- WCRF Recommendation: http://www.wcrf.org/int/research-we-fund/cancer-prevention-recommendations/animal-foods
- WCRF Continuous Update Project: http://www.wcrf.org/int/research-we-fund/continuous-update-project-findings-reports/continuous-update-project-cup-matrix
- Stewart BW, Wild CP, [ed]: World Cancer Report 2014. International Agency for Research Cancer, Lyon, 2014.

Autor mgr inż. Iwona Sajór | 2.02.2018 | Choroba a dieta, Nowotwory
Powszechnie wiadomo, że w procesie leczenia chorób onkologicznych ważną rolę wspomagającą odgrywa dieta, dlatego też duże nadzieje wśród chorych rozbudzają wszelkie nowinki związane z wpływem żywienia na rozwój nowotworów. W ostatnim czasie coraz bardziej modna dieta ketogeniczna jest promowana wśród pacjentów onkologicznych jako alternatywny sposób żywienia niszczący komórki rakowe. Warto jednak odpowiedzieć sobie na pytanie, czy taki schemat żywienia ma uzasadnienie naukowe i czy jest bezpieczny dla tej grupy chorych, skoro budzi kontrowersje nawet w przypadku osób zdrowych.
Jak obecność nowotworu wpływa na organizm i jego zapotrzebowanie na składniki odżywcze?
Omówienie tego zagadnienia należy zacząć od wyjaśnienia licznych zmian zachodzących w organizmie osoby chorej na nowotwór i ich wpływu na zapotrzebowanie na energię i składniki odżywcze. Liczne badania potwierdziły, że proces nowotworowy uruchamia w organizmie chorego kaskadę zdarzeń, które bardzo często prowadzą do ograniczenia ilości przyjmowanego pokarmu, ubytku masy ciała i w konsekwencji do pogorszenia stanu odżywienia.
Dzieje się tak, ponieważ szybko namnażające się komórki nowotworowe potrzebują do rozwoju składników odżywczych w postaci cukrów prostych (glukozy). Pozyskując je z organizmu gospodarza nowotwór wytwarza wiele substancji zaburzających prawidłową gospodarkę tłuszczowo-węglowodanową. Obecność guza wpływa przy tym na wydzielanie hormonów regulujących odczuwanie głodu i sytości. Skutkiem tych zaburzeń jest wytworzenie dużej ilości mleczanów – substancji, których wysokie stężenie we krwi powoduje zaburzenia łaknienia, nudności, niekiedy wymioty i stany lękowe.
Ponadto obecność nowotworu pobudza układ odpornościowy gospodarza do produkcji cytokin – białek odpowiedzialnych za odpowiedź obronną organizmu – która jest zbyt słaba, aby zwalczyć nowotwór, ale zwiększa istotnie zużycie białka ustrojowego. Choroba nowotworowa ma charakter przewlekły, a więc cytokiny są produkowane przez cały czas jej trwania a długotrwałe wzmożone działanie układu odpornościowego wpływa na obniżenie apetytu.
Podstawowa przemiana materii u osoby chorej na nowotwór zwiększa się średnio o 10-20% w porównaniu z tą sprzed choroby. Zatem jeśli zapotrzebowanie organizmu na składniki odżywcze nie jest pokrywane za pomocą diety, uruchamiany jest proces pozyskiwania glukozy i aminokwasów (białka) z tkanki mięśniowej. W tym czasie również powstają mleczany, odpowiedzialne za utratę apetytu i złe samopoczucie.
Rozwój nowotworu zmusza organizm chorego do zużywania zapasów ustrojowych (glikogenu z wątroby, białek narządowych i mięśniowych) a to uniemożliwia ich zwykłą odbudowę. Te rezerwy szybko topnieją nawet u osoby z dobrym stanem odżywienia przed chorobą, nie mówiąc o chorym niedożywionym. Sytuacja pacjenta z nowotworem umiejscowionym w przewodzie pokarmowym jest jeszcze trudniejsza. Wzrost guza może utrudniać gryzienie, powodować ból w czasie połykania, uczucie szybkiego nasycenia po spożyciu niewielkiej ilości pokarmu, nudności i wymioty, jadłowstręt, niedrożność przewodu pokarmowego i/lub zaburzenia trawienia i wchłaniania składników odżywczych zawartych w pożywieniu.
Nie można zapominać, że stan odżywienia może pogarszać również leczenie onkologiczne – operacje chirurgiczne, chemioterapia i radioterapia – pomimo, że są najskuteczniejszym sposobem leczenia nowotworów, niosą za sobą wiele działań niepożądanych o różnym nasileniu. Największy wpływ na sposób żywienia mają towarzyszące terapii: nudności, wymioty, biegunki, zaparcia, ból podczas żucia i połykania pokarmów, zapalenie błon śluzowych przewodu pokarmowego, zaburzenia smaku i węchu.
Częstym skutkiem współdziałania tych wszystkich czynników jest zmniejszenie ilości spożywanego pokarmu, fałszywe odczuwanie sytości oraz ujemny bilans energetyczny i białkowy, co prowadzi często do utraty masy ciała jeszcze przed rozpoznaniem choroby i stan ten ulega dalszemu pogorszeniu w czasie jej leczenia. Badania epidemiologiczne wykazują, że aż u 50-70% chorych na nowotwór stwierdza się różnego rodzaju zaburzenia odżywiania. Natomiast u 5-20% pacjentów onkologicznych niedożywienie lub wyniszczenie, a nie choroba nowotworowa, jest główną przyczyną śmierci.
Standardy leczenia żywieniowego u chorych w trakcie leczenia onkologicznego i w okresie rekonwalescencji
Zapotrzebowanie na energię i składniki odżywcze u osób chorych na nowotwory jest indywidualne i powinno być ustalone w oparciu o wiek, płeć, aktualny stan odżywienia, poziom aktywności fizycznej, inne choroby, rodzaj nowotworu i sposób jego leczenia.
W standardach leczenia żywieniowego w onkologii z 2015 r. (Kłęk S. i wsp., Nowotwory Journal of Oncology) rekomendowany jest następujący udział składników odżywczych w całodziennym zapotrzebowaniu energetycznym: 35-50% z węglowodanów, 30-50% z tłuszczów i 15-20% z białka. Szeroki zakres udziału energii z węglowodanów i tłuszczów daje możliwość zindywidualizowania ilości makroskładników w diecie każdego chorego, w zależności od rodzaju nowotworu, stopnia zaawansowania choroby, stanu odżywienia, metody i tolerancji leczenia a także innych chorób współistniejących. Na przykład u chorych z nowotworami płuca częściej rozwija się niedożywienie a nawet wyniszczenie, dlatego w diecie zwiększa się podaż produktów będących źródłem tłuszczów, zwłaszcza wielonienasyconych z rodziny n-3, które zmniejszają stan zapalny i stabilizują procesy metaboliczne w organizmie. Podobnie postępuje się u pacjentów z chorobą nowotworową, u których stwierdzono insulinooporność i utratę masy ciała – kosztem węglowodanów zwiększa się procent energii z tłuszczów. Inaczej jest u osób z nowotworami zlokalizowanymi w obrębie układu limfatycznego, żołądka, trzustki, piersi, prostaty czy jelit – nadmiar tłuszczu w pożywieniu może nasilać u nich nudności, uczucie szybkiego nasycenia po posiłku i biegunki a wraz z upływem czasu może rozwijać jadłowstręt. Procentowy udział białka, niezależnie od proporcji węglowodanów i tłuszczów, pozostaje na poziomie 15-20%. Jest to konieczne, aby zapewnić odpowiednią ilość aminokwasów na bieżące potrzeby organizmu oraz te związane z nasilonym procesem zapalnym i regeneracją komórek uszkodzonych w procesie leczenia (gojenie się ran pooperacyjnych, odbudowa tkanek zniszczonych przez naświetlania czy chemioterapię).
Oczywiście poza odpowiednią ilością węglowodanów, tłuszczów i białka w diecie, bardzo ważne są ich źródła w żywności (więcej w artykule: Zalecenia i przeciwwskazania dietetyczne w chorobach nowotworowych). U chorych na nowotwory obserwuje się niedobory niektórych witamin i składników mineralnych (dotyczy to szczególnie antyoksydantów), w związku z tym zaleca się zwiększenie spożycia produktów, które są ich źródłem – warzyw, owoców, niskoprzetworzonych produktów zbożowych.
Właściwie skomponowana dieta u chorych na nowotwory jest istotnym elementem wspomagającym leczenie, gdyż pozwala utrzymać dobry stan odżywienia, poprawia tolerancję interwencji chirurgicznych, zmniejsza ryzyko wystąpienia powikłań pooperacyjnych oraz działań niepożądanych towarzyszących radioterapii, chemioterapii i hormonoterapii. Prawidłowe nawyki żywieniowe mogą zmniejszyć też ryzyko nawrotu choroby w przyszłości.
Czy niskowęglowodanowa dieta ketogeniczna jest bezpieczna dla chorych na nowotwory?
Wiedza na temat prawidłowego żywienia w czasie leczenia choroby nowotworowej jest niewystarczająco rozpowszechniona wśród chorych, co więcej istnieje wiele mitów w tym zakresie i pacjenci lub ich bliscy często ulegają niesprawdzonym a niekiedy wręcz szkodliwym teoriom. Należy podkreślić, że naukowcy z całego świata nieustannie sprawdzają różne sposoby wpływania na komórki nowotworowe za pomocą składników pożywienia oraz modyfikacji proporcji poszczególnych składników odżywczych w diecie. Niemniej jednak, aby móc z całą pewnością stwierdzić skuteczność jakiegokolwiek czynnika należy wykonać wiele badań laboratoryjnych i klinicznych – najpierw na zwierzętach a następnie potwierdzić je u dużej liczby ludzi, w tym przypadku z tym samym nowotworem, w tym samym stadium zaawansowania, leczonym taką samą metodą. Takie badania kliniczne trwają wiele lat i prowadzone są w kilku etapach (zwykle 4 fazy), przy czym każdy z nich musi się zakończyć wynikiem pozytywnym, aby móc przejść do kolejnego.
W przeszłości wielokrotnie podejmowano różne próby wpływania na komórki nowotworowe zabierając im dostęp do składników odżywczych, jednak większość tych obserwacji skończyła się jednym wnioskiem – nie można zagłodzić raka nie powodując wyniszczenia organizmu chorego, a tym samym zmniejszenia jego szans na wyzdrowienie.
Pewne nadzieje rozbudziły w ostatnich latach pojedyncze obserwacje zastosowania diety ketogenicznej u zwierząt i ludzi z pierwotnymi nowotworami mózgu, w przypadku których rokowanie jest wyjątkowo złe – tradycyjne metody z wykorzystaniem leczenia chirurgicznego, radioterapii i chemioterapii dają szanse przeżycia: dla chorych na gwiaździaka anaplastycznego – średnio 3 lata, dla chorych z glejakiem wielopostaciowym – średnio od 15 do 18 miesięcy a dla chorych z niskozłośliwymi guzami mózgu (gwiaździaki, skąpodrzewiaki) – średnio od 5 do 10 lat. Zbudowano tezę, że drastyczne ograniczenie w diecie węglowodanów (produktów zbożowych, warzyw, owoców, nasion roślin strączkowych, mleka i produktów mlecznych, cukru) i zastąpienie ich tłuszczami (masło, smalec, oleje, tłuste mięso i ryby, jaja, orzechy, nasiona, awokado) spowoduje ograniczenie namnażania się komórek nowotworowych i ich śmierć. Założono, że skutkiem takiej modyfikacji diety będzie odcięcie komórek nowotworowych od jedynego dla nich źródła energii jakim jest glukoza i wytworzenie ciał ketonowych, którymi mogą odżywiać się zdrowe komórki organizmu. Dodatkowym mechanizmem niszczącym guz ma być zwiększenie stresu oksydacyjnego wewnątrz komórek nowotworowych.
U pojedynczych chorych leczonych z powodu glejaka tradycyjnymi metodami w warunkach szpitalnych zastosowano równolegle dietę ketogeniczną z udziałem około 90% energii z tłuszczu, 2-5% z węglowodanów i 5-8% w białka a także suplementacją niedoborowych witamin i składników mineralnych. Niektóre obserwowane efekty były obiecujące, m.in.: dochodziło do zahamowania nowotworu, guzy ulegały zmniejszeniu, redukcji ulegała ilość naczyń odżywiających nowotwór. Należy jednak pamiętać, że wszystkie te przedkliniczne obserwacje dotyczyły pojedynczych chorych i aby móc potwierdzić ich skuteczność dla chorych z nowotworami (mózgu i/lub innymi rodzajami) należy rozpocząć badania kliniczne w tym zakresie.
Nie można też nie wspomnieć, że stosowanie diety ketogenicznej przez osoby chore na nowotwory może powodować wiele poważnych konsekwencji zdrowotnych, m.in.: dyskomfort w przewodzie pokarmowym, nudności i wymioty, wzrost ciał ketonowych we krwi, śpiączkę, hipoglikemię, deficyt witamin, składników mineralnych i antyoksydantów, nasilenie procesów zapalnych, zmiany rytmu wypróżnień (biegunki, zaparcia), utratę masy ciała. Przewlekłe stosowanie schematu żywienia opartego w 90% na tłuszczach może skutkować zwiększeniem stężenia frakcji LDL cholesterolu, utratą masy mineralnej kości, tworzeniem się kamieni w nerkach i uszkodzeniem nerek.
Biorąc pod uwagę częste problemy z żywieniem w przebiegu choroby nowotworowej, dieta ketogenna, oparta w przeważającej części na olejach (kokosowy, lniany, oliwa z oliwek), maśle, smalcu, tłustym mięsie (boczek, golonka), tłustych rybach, orzechach, pestkach, oliwkach, awokado może także nasilać już istniejące dolegliwości, głównie ze strony przewodu pokarmowego. Jest to szczególnie niebezpieczne, bo zwiększa ryzyko rozwoju jadłowstrętu, niedożywienia i nieodwracalnego wyniszczenia nowotworowego. Nie bez znaczenia jest fakt, że taka dieta jest niedoborowa w wiele składników odżywczych a suplementacja u większości osób leczonych z powodu chorób nowotworowych jest przeciwwskazana ze względu na ryzyko groźnych interakcji ze stosowanymi środkami farmakologicznymi.
Wszelkie istotne modyfikacje w diecie pacjenta onkologicznego powinny odbywać się po konsultacji z lekarzem prowadzącym i pod kontrolą doświadczonego dietetyka. Nie należy ulegać niesprawdzonym modom żywieniowym, ponieważ może to zmniejszyć szanse na wyleczenie choroby nowotworowej.
Arends J., Bachman P., Baracos V., et al.: , ESPEN guidelines on nutrition in cancer patients, Clinical Nutrition, 2016, http://dx.doi.org/10.1016/j.clnu.2016.07.015
Kłęk S., Jankowski M., Kruszewski W.J. i wsp.: Standardy leczenia żywieniowego w onkologii. Nowotwory Journal of Oncology, 2015, 65, 4, 3, 210-337.
Krzakowski M., Kawecki A. [red]: Nowotwory złośliwe. Postępowanie wielodyscyplinarne. Tom II. Wydawnictwo Czelej, Lublin, 2012
National Cancer Institute. Eating Hints Before, During, and After Cancer. 2011. www.cancer.gov/publications/patient-education/eating-hints on May 20, 2015.
Demark-Wahnefried W., Rogers L.Q., Alfano C.M., et al.: Practical clinical interventions for diet, physical activity, and weight control in cancer survivors. . CA: A Cancer Journal for Clinicians.2015, 65, 167-189.
Allen B.G., Bhatia S.K., Anderson C.M. et al.: Ketogenic diets as an adjuvant cancer therapy: history and potencial mechanism. Redox Biology, 2014, 2, 963-970.
Zuccoli G., Marcello N., Pisanello A. et al.: Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: case report. Nutrition & Metabolism, 2010, 7, 33.













